

 https://orcid.org/0000-0002-5408-6263
https://orcid.org/0000-0002-5408-6263
El cáncer, en sus más de 200 formas, es una de las principales causas de muerte en todo el mundo. Según la Organización mundial de la Salud (OMS) cada año fallecen 8,2 millones de personas y más de 32 millones de personas viven en el mundo con un diagnóstico de cáncer, además de asegura que la cifra de nuevos casos, que cada año suman más de 14 millones, se incrementará70% en los próximos 20 años.
En oncología, el uso de la tomografía computarizada (TC) ha sido la prueba de elección en el paciente oncológico, proporcionando información morfológica de los cambios producido por la enfermedad tumoral. En la pasada década la aparición de la tomografía por emisión de positrones (PET)-FDG se convirtió en la técnica de elección en el manejo de los pacientes. La reciente integración de ambas modalidades en un solo equipo ofrece ventajas desde el punto de vista clínico. Hay menos confusión respecto a las captaciones de FDG no oncológicas, zonas de inflamación o la captación fisiológica de estructuras normales como la grasa parda o la musculatura, al ser más fácilmente localizables anatómicamente. Además, la PET-TC permite una mejor localización de las lesiones malignas, un mejor control del tratamiento, un mejor abordaje en la realización de biopsias y en la planificación de los tratamientos radioterápicos. La PET-TC permite también detectar lesiones neoplásicas sin avidez por la FDG, que no son detectadas por la PET. La PET-TC debería ser el único procedimiento diagnóstico a realizar en la mayoría de los procesos oncológicos, evitando la realización de una TC añadida, especialmente en oncología pediátrica. Es necesaria una estrecha colaboración entre los médicos nucleares y los radiólogos para obtener la máxima información posible de estos equipos. Sólo en hospitales donde colaboren estrechamente facultativos de las distintas especialidades: Medicina Nuclear, Radiodiagnóstico y Oncología Radioterápica, será sacar el máximo rendimiento diagnóstico a una exploración tan importante en oncología como es la PET-TC.
Con este artículo de actualización se pretende realizar una revisión bibliográfica realizada en el MEDLINE de toda la literatura publicada en los últimos cinco años (marzo 2011-mayo 2016), con las siguientes palabras clave: PET-CT; Positron-emission tomography; Cone-beam computed tomography; Medical oncology; Radiation oncology; Diagnostic imaging, para valorar el uso del PET TAC en oncología Radioterápica.
La oncología es la especialidad médica que estudia y trata las neoplasias (tumores benignos y malignos), pero con especial atención a los tumores malignos o cáncer. El término oncología deriva del griego antiguo ογκοςoncos(masa o tumor) y λογος,ου -logos-ou(estudio).
«Cáncer» es un término genérico que designa un amplio grupo de enfermedades que pueden afectar a cualquier parte del organismo; también se habla de «tumores malignos» o «neoplasias malignas». Una característica definitoria del cáncer es la multiplicación rápida de células anormales que se extienden más allá de sus límites habituales y pueden invadir partes adyacentes del cuerpo o propagarse a otros órganos, un proceso que se denomina «metástasis». Las metástasis son la principal causa de muerte por cáncer.
El cáncer, en sus más de 200 formas, es una de las principales causas de muerte en todo el mundo. Según la Organización mundial de la Salud (OMS) cada año fallecen 8,2 millones de personas y más de 32 millones de personas viven en el mundo con un diagnóstico de cáncer, además de asegura que la cifra de nuevos casos, que cada año suman más de 14 millones, se incrementará70% en los próximos 20 años[1].
Es la segunda causa de muerte en el mundo; en 2015, ocasionó 8,8 millones de defunciones. Casi una de cada seis defunciones en el mundo se debe a esta enfermedad y cerca del 70% de las muertes por cáncer se registran en países de ingresos medios y bajos. (Figura 1)
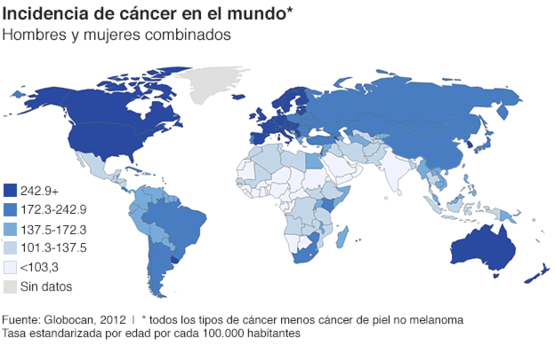
Figura 1. Incidencia de cáncer en el mundo.
Alrededor de un tercio de las muertes por cáncer se debe a los cinco principales factores de riesgo conductuales y dietéticos: índice de masa corporal elevado, ingesta reducida de frutas y verduras, falta de actividad física, consumo de alcohol y tabaco, siendo este último el principal factor de riesgo y ocasiona aproximadamente el 22% de las muertes por cáncer[2].
Las infecciones oncogénicas, entre ellas las causadas por virus de las hepatitis o por papilomavirus humanos, ocasionan el 25% de los casos de cáncer en los países de ingresos medios y bajos[3].
La detección de cáncer en una fase avanzada y la falta de diagnóstico y tratamiento son problemas frecuentes. En 2015, solo el 35% de los países de ingresos bajos informaron de que la sanidad pública contaba con servicios de patología para atender a la población en general. Más del 90% de los países de ingresos altos ofrecen tratamiento a los enfermos oncológicos, mientras que en los países de ingresos bajos este porcentaje es inferior al 30%.
El impacto económico del cáncer es sustancial y va en aumento. Según las estimaciones, el costo total atribuible a la enfermedad en 2010 ascendió a US$ 1,16 billones y sólo uno de cada cinco países de ingresos medianos o bajos dispone de los datos necesarios para impulsar políticas de lucha contra la enfermedad[4].

Figura 2. Causas de cáncer
El cáncer se produce por la transformación de las células normales en tumorales, siendo un proceso que se sucede a lo largo de varias etapas que pueden ir desde una lesión precancerosa hasta un tumor maligno. (Figura 2). Estas alteraciones son el resultado de la interacción entre los factores genéticos del paciente y tres categorías de agentes externos:
La OMS mantiene una clasificación de los agentes cancerígenos a través de un órgano especializado, el Centro Internacional de Investigaciones sobre el Cáncer (CIIC). El envejecimiento es otro factor fundamental en la aparición del cáncer. La incidencia de esta enfermedad aumenta muchísimo con la edad, muy probablemente porque se van acumulando factores de riesgo de determinados tipos de cáncer. La acumulación general de factores de riesgo se combina con la pérdida de eficacia de los mecanismos de reparación celular que suele ocurrir con la edad. (Figura 3)

Figura 3. Carcinógenos
El consumo de tabaco y de alcohol, la mala alimentación y la inactividad física son los principales factores de riesgo de cáncer en el mundo, y lo son también de otras enfermedades no transmisibles. Algunas infecciones crónicas particularmente frecuentes en los países de ingresos medios y bajos son también factores de riesgo de contraer un cáncer. Cerca del 15% de los casos de cáncer diagnosticados en 2012 se atribuyeron a infecciones, especialmente las causadas por Helicobacter pylori, los papilomavirus humanos, los virus de la hepatitis B y de la hepatitis C y el virus de Epstein-Barr3.
Los virus de la hepatitis B y de la hepatitis C y algunos tipos de papilomavirus humanos aumentan el riesgo de contraer cáncer de hígado y cáncer de cuello uterino, respectivamente. Asimismo, la infección por el VIH aumenta considerablemente el riesgo de contraer determinados tipos de cáncer, como el cervicouterino. (Figura 4)
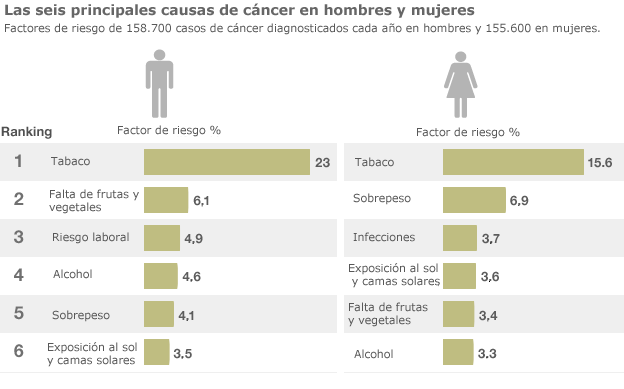
Figura 4. Principales causas
Entre el 30 y el 50% de los cánceres se pueden evitar. Para ello, es necesario reducir los factores de riesgo y aplicar estrategias preventivas de base científica. La prevención abarca también la detección precoz de la enfermedad y el tratamiento de los pacientes. Si se detectan a tiempo y se tratan adecuadamente, las posibilidades de recuperación para muchos tipos de cáncer son excelentes. (Figura 5)

Figura 5. Prevención del cáncer
La modificación o la prevención de los principales factores de riesgo pueden reducir de forma significativa la carga de cáncer. Estos factores de riesgo incluyen:
El tabaquismo es el factor de riesgo de cáncer más importante y ocasiona aproximadamente el 22% de las muertes por cáncer a nivel mundial2.
Para prevenir la aparición de cáncer se adoptan diversas medidas como:
La vacunación contra los papilomavirus humanos y contra el virus de la hepatitis B podría prevenir 1 millón de casos de cáncer cada año3.
La mortalidad por cáncer se puede reducir si los casos se detectan y se tratan a tiempo. Las actividades de detección temprana tienen dos componentes:
El diagnóstico temprano: Si el cáncer se diagnostica tempranamente, es más probable que el tratamiento sea eficaz. La probabilidad de supervivencia aumenta, la morbilidad se reduce y el tratamiento es más barato. El diagnóstico y tratamiento precoces comportan mejoras notables en la vida de los pacientes.
Éste abarca tres pasos sucesivos, que se deben integrar y llevar a cabo oportunamente:
El diagnóstico temprano es útil en todas las situaciones para la mayoría de tipos de cáncer. Cuando la enfermedad se diagnostica en una fase avanzada, no siempre es posible administrar un tratamiento curativo. No obstante, es posible elaborar programas que permitan reducir los retrasos y los obstáculos que impiden proporcionar los servicios de diagnóstico y tratamiento adecuados.
El cribado: El objetivo del cribado o detección sistemática es encontrar anomalías indicativas de un cáncer o de una lesión precancerosa cuando no ha producido síntomas, con el fin de diagnosticar y tratar prontamente la enfermedad.
Los programas de cribado pueden ser muy eficaces para determinados tipos de cáncer si seleccionan y utilizan las pruebas apropiadas, se aplican paralelamente otras medidas en el contexto de la detección y se garantiza la calidad de las intervenciones. En general, los programas de cribado son intervenciones de salud pública mucho más complejas que el diagnóstico temprano.
El diagnóstico correcto del cáncer es esencial para poder prescribir un tratamiento adecuado y eficaz, porque cada tipo de cáncer requiere un protocolo específico que puede abarcar una o más modalidades, tales como la cirugía, la radioterapia o la quimioterapia. El primer paso importante es determinar los objetivos del tratamiento o los cuidados paliativos. Los servicios médicos ofrecidos deben ser integrados y centrados en las personas. El objetivo principal es curar el cáncer o prolongar en lo posible la vida del paciente. Otro objetivo importante es mejorar la calidad de vida. (Figura 6)

Figura 6. Tratamiento del cáncer.
Algunos de los tipos de cáncer más frecuentes, como el de mama, el cervicouterino, el bucal o el colorrectal, tienen tasas de curación elevadas cuando se detectan pronto y se tratan de acuerdo con prácticas correctas. Las tasas de curación de otros tipos de cáncer, como las leucemias y los linfomas infantiles o los seminomas, también son elevadas si se tratan adecuadamente, a pesar de que las células cancerosas se hayan diseminado a otras partes del organismo.
Cuando la enfermedad no se puede curar, hablamos de Cuidados paliativos. Su finalidad no es curar el cáncer, sino aliviar los síntomas producidos por esta y mejorar la calidad de vida de los pacientes y de sus familias. Pueden ayudar a los enfermos a vivir más confortablemente y son una necesidad humanitaria urgente para las personas de todo el mundo aquejadas de cáncer o de otras enfermedades crónicas mortales. Estos cuidados se necesitan sobre todo en los lugares donde hay una gran proporción de pacientes cuya enfermedad se encuentra en fase avanzada y que tienen pocas probabilidades de curarse. (Figura 7)
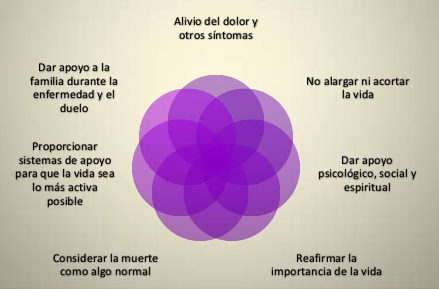
Figura 7. Cuidados paliativos.
Los cuidados paliativos pueden aliviar los problemas físicos, psicosociales y espirituales de más del 90% de los enfermos con cáncer avanzado.
Las estrategias eficaces de salud pública que abarcan la atención fuera de los centros de salud y en el propio hogar son esenciales para ofrecer servicios de cuidados paliativos y de alivio del dolor que puedan ayudar a los enfermos y a sus familias en los entornos con pocos recursos.
El tratamiento del dolor moderado a intenso causado por el cáncer, que aqueja a más del 80% de los enfermos oncológicos en fase terminal, requiere obligatoriamente una mejora del acceso al tratamiento con morfina por vía oral.
En 2013, la OMS puso en marcha elPlan de acción mundial para la prevención y el control de las enfermedades no transmisibles 2013-2020, cuyo objetivo es reducir en un 25% la mortalidad prematura causada por el cáncer, las enfermedades cardiovasculares, la diabetes y las enfermedades respiratorias crónicas de aquí a 2025.
La OMS y el Centro Internacional de Investigaciones sobre el Cáncer colaboran con otras organizaciones que forman parte del Equipo de Tareas Interinstitucional de las Naciones Unidas sobre la Prevención y el Control de las Enfermedades No Transmisibles y con otros asociados, con el fin de:
La radiología es esencial para el manejo del cáncer, con una gran variedad de herramientas y técnicas disponibles para la detección, la estadificación y el tratamiento de la enfermedad. Pero lo menos conocido es el valor del diagnóstico por imágenes en el reconocimiento de manifestaciones tempranas de cáncer y pequeños tumores clínicamente indetectables, antes de que se manifiesten; una capacidad que hace a la radiología tenga un lugar muy importante en la atención oncológica. Expertos médicos están de acuerdo en que la mayoría de los cánceres se pueden tratar con eficacia si se detectan temprano. En este sentido, el diagnóstico por imágenes es superado solo por los análisis de laboratorio en lo que respecta a las herramientas más valiosas que los equipos de atención oncológica tienen a su disposición. En particular, las distintas pruebas radiológicas se han vuelto muy útiles para la detección ya que pueden mostrar lesiones precancerosas antes de que se vuelvan malignas y causen síntomas. La detección y prevención de la enfermedad se han vuelto esenciales en la lucha contra el cáncer, en especial en personas con mayor riesgo de desarrollar la enfermedad, una parte de la población general que continuará creciendo en todo el mundo en las próximas décadas.
Aunque la radiología no puede prevenir el cáncer, es de mucha ayuda para detectar situaciones precancerosas como pólipos en colon, nódulos cirróticos en hígado,… La detección temprana de un tumor puede hacer que el tratamiento sea más simple, menos costoso e incluso que se pueda curar[6].
En lo que respecta al cáncer, la atención del paciente es un trabajo de equipo y no el de un solo médico. Un enfoque interdisciplinario y un buen trabajo en equipo entre los distintos médicos son esenciales para la atención exitosa de los pacientes con cáncer, desde la detección hasta el tratamiento y el seguimiento. El rol del radiólogo no se limita a la etapa entre la detección y el diagnóstico, sino que abarca más ya que el radiólogo también participará en la elección del tratamiento, su control, administración y seguimiento.
Además de beneficios a través del diagnóstico por imágenes, debemos estar al tanto de los posibles efectos secundarios y desventajas que van de la mano con algunas técnicas. Algunos métodos exponen al cuerpo humano a cantidades más grandes de radiación que otros, y otros, como la ecografía y la IRM, no usan radiación. Es importante que los pacientes conozcan tal información para que entiendan por qué el radiólogo debe decidir en cada caso concreto qué método es más adecuado. Esto es particularmente importante en los pacientes con afecciones especiales, que pueden por ejemplo ser alérgicos a los agentes de contraste o tener implantes metálicos, en el caso de la exploración por IRM. El embarazo también limita el uso de ciertos métodos.
El diagnóstico por imágenes depende en gran medida de la tecnología, de modo que el progreso y el desarrollo futuro en el campo de la tecnología de diagnóstico por imágenes son fundamentales para el progreso de la disciplina en sí. En los últimos 40 años, ha habido importantes innovaciones en este campo, como la TC y la IRM, que actualmente alcanzan un alto nivel de precisión diagnóstica y resolución espacial al combinarlas con los métodos de diagnóstico por imágenes moleculares, que para los radiólogos es la herramienta más prometedora para el futuro. Los primeros estadios del cáncer y otras enfermedades son detectables usando marcadores biológicos personalizados que pueden descubrir los rastros más pequeños de la enfermedad. El uso de glucosa marcada radiactivamente en combinación con la PET, que puede producir una imagen tridimensional de un proceso funcional del cuerpo, se ha convertido en una parte integral del diagnóstico del cáncer. A medida que los tumores o la inflamación consumen altos niveles de glucosa, el radiólogo puede rastrear con facilidad la ubicación y propagación de la enfermedad.
Pero no son solo los métodos de desarrollo reciente los que aportan mejoras en la detección del cáncer; métodos establecidos como la IRM también tienen mucho que ofrecer. Hasta el momento, la mayoría de los dispositivos de RM operan a una intensidad de campo magnético de 1,5 y 3 teslas, pero en experimentos, se han alcanzado intensidades de hasta 11 teslas y se han logrado imágenes de calidad extremadamente alta. Las imágenes ponderadas por difusión, que permiten el mapeo el mapeo del proceso de difusión de moléculas, ya han demostrado algunos resultados muy positivos, y sin dudas se lograrán más desarrollos que ayudarán a comprender la función, estructura y evolución de tejidos como el cáncer cuando se administra tratamiento.
La PET-RM es una modalidad de diagnóstico por imágenes de última generación y ha sido sacada a la venta por algunos proveedores hace muy poco. Comparada con la PET-TC, la PET-RM proporciona una mejor imagen de fondo con un mejor contraste del tejido blando sin exposición a radiación. Además, la integración de información molecular y funcional generada a partir de la PET y la RM podría brindar información útil para la caracterización del cáncer[7].
Por supuesto que es difícil predecir de qué manera los nuevos métodos o dispositivos afectarán el diagnóstico por imágenes oncológico y cuándo podrán utilizarlos los pacientes. Lo que sí se puede afirmar es que en el futuro el diagnóstico por imágenes se convertirá en una herramienta aún más poderosa para la detección del cáncer, en especial cuando los marcadores biológicos y métodos moleculares se hayan desarrollado en su máximo potencial.
En oncología no existe una exploración perfecta, necesitando combinar múltiples para llegar a un diagnóstico oncológico, evaluar el grado de actividad tumoral, la eficacia de los tratamientos, así como para realizar un seguimiento del paciente pudiendo valorar toxicidades, respuestas o recidivas de la enfermedad[8].
Es lo primero en realizarse y consiste en la valoración por parte del médico de la situación general del paciente y de los diferentes síntomas para conocer cuál es su situación y decidir las pruebas radiológicas o de toma de muestra tumoral a efectuar. Es clave para diagnosticar la enfermedad en su inicio así como a la hora de evaluar la eficacia o no de un tratamiento. Sin una buena historia clínica, el médico no va a poder ser capaz de ordenar la prueba diagnóstica más adecuada para el paciente ni llegar a un diagnóstico certero ni poder tomar la decisión terapéutica más adecuada.
Del mismo modo que ocurre con la historia clínica, la información que un médico puede obtener dela exploración física del paciente es determinantea la hora de orientar el diagnóstico y la evolución de un paciente. Debe ser exhaustiva y puede orientarnos sobre la localización del tumor y de la presencia de posibles metástasis a distancia.
Radiografía simple
Es la primera exploración que se realiza en la mayoría de las ocasiones. Normalmente se suele realizar antes de la cirugía de los pacientes y sirve para descartar la existencia de metástasis pulmonares derivadas del tumor primario si la radiografía es de tórax o metástasis en los huesos si la radiografía es ósea.
TAC (Tomografía Axial Computerizada)
Es una técnica de rayos X en la que se visualizan las distintas áreas del cuerpo. Se utiliza para valorar la extensión del tumor a otros órganos y sólo se considera necesaria en algunos casos. Tiene una resolución mucho mayor que la que permite la radiografía simple. Es la técnica más empleada para el diagnóstico, seguimiento y evaluación de la eficacia de los tratamientos en Oncología.
RMN (Resonancia Magnética Nuclear)
Es la técnica más sensible y específica para el estudio de las lesiones en el sistema nervioso central. Presenta una alta resolución para poder observar los tejidos blandos. Consiste en la utilización de la acción de un campo electromagnético de manera que eso se traduce en la generación de imágenes de alta resolución. Es de elevada utilidad en el diagnóstico de tumoraciones mamarias ocultas, tumores óseos, compresiones medulares metastásicas, tumores cerebrales y en el diagnóstico diferencial de metástasis hepáticas con hemangiomas.
Gammagrafía Ósea
Es un examen que detecta áreas de aumento o disminución en el metabolismo de los huesos. Se utiliza principalmente en el estudio de extensión de un tumor para conocer si se ha extendido o no a los huesos. Presenta una alta utilidad en el cáncer de mama, próstata, pulmón y riñón.
Gammagrafía Tiroidea
Es una técnica útil para el diagnóstico de tumores y metástasis tiroideas y en el tratamiento del cáncer tiroideo diferenciado. La técnica consiste en introducir en la sangre del paciente iodo marcado radiactivamente que va a depositarse en las células tiroideas, tanto normales como tumorales, destruyéndolas por la propia radiación.
Gammagrafía con Metaiodobencilguanidina (MIBG)
Es especialmente útil en el diagnóstico de feocromocitomas y meduloblastomas infantiles
Mamografía
Consiste en una serie de imágenes de Rayos X que detectan zonas anómalas en la mama. No tiene un 100% de fiabilidad por lo que pueden dar imágenes sospechosas que finalmente no sean malignas (falsos positivos) o dejar de diagnosticar algún tumor maligno (falsos negativos). Es la prueba de elección tanto para el cribado como el diagnóstico del cáncer de mama. La imagen de un tumor se aprecia como un acúmulo de pequeñas calcificaciones en el seno del tejido mamario.
Ecografía
Consiste en una técnica que emplea los ultrasonidos para producir una imagen que nos va hacer capaces de distinguir entre formaciones quísticas (rellenas de líquido y que normalmente no son tumorales) y lesiones sólidas (más sospechosas de tumor). Se la considera como la exploración esencial para el estudio de las vísceras abdominales y es complementaria al TAC. Su alta sensibilidad a la hora de detectar metástasis en el hígado, la convierten en la prueba de diagnóstico inicial para llevar a cabo el estudio de extensión de cualquier tumor que sea capaz de dar metástasis hepáticas. Cuenta también con alta utilidad en el diagnóstico diferencial de nódulos mamarios.
Una variante de la ecografía tradicional es la ecografía endoscópica. Este método diagnóstico consiste en introducir un pequeño endoscopio por los distintos orificios del cuerpo, de tal manera que disponemos de la endoscopia trasnrectal y de la endoscopia esofago-gástrica que sirven de gran utilidad para el diagnóstico y estadificación de tumores de recto, próstata, esófago y estómago.
PET (Tomografía de Emisión de Positrones)
Es una prueba que combina los conocimientos de la Medicina Nuclear con los de la Radiología. Consiste en inyectar azúcar marcado radiactivamente en el cuerpo del paciente. Las células tumorales, debido a su alto metabolismo (son más activas que las células sanas) tienen mayor necesidad de azúcar, por lo que lo absorben con mayor rapidez que las células sanas. De este modo, las células tumorales se van a iluminar en el estudio radiológico posterior. Los estudios de PET se utilizan con mayor frecuencia para complementar la información reunida a través de estudios previos realizados con TAC, RMN o en la exploración física. Aunque probablemente se trate de la prueba más específica y sensible en el campo de la Oncología, el PET tiene una serie de inconvenientes ya que hay tejidos normales como el corazón y el cerebro, o bien los tumores benignos, que van a ser capaces de captar azúcar con la misma avidez que el cáncer.
Las principales indicaciones del PET son el diagnóstico diferencial de nódulos pulmonares solitarios, estudio inicial y de enfermedad residual de linfomas, malignidad de tumores cerebrales y diagnóstico de los tumores primarios de origen desconocido.
Consisten en obtener una muestra del tejido o de células del tumor que permitan en su análisis determinar de qué tipo de tumor se trata y qué grado de malignidad presenta
Biopsia
Una biopsia consiste en la extracción de una muestra de tejido de la zona sospechosa de un órgano determinado para analizarlo posteriormente en el microscopio y poder determinar las características benignas o malignas del mismo, así como el tipo de células tumorales que lo componen, el grado de agresividad de las mismas y algún otro parámetro de interés a la hora de tomar decisiones sobre el tratamiento.
Citología
Consiste en la visualización bajo el microscopio de muestras de exudados o líquidos del cuerpo procedentes del lugar donde sospechamos que se encuentra el tumor. por ejemplo, si sospechamos un cáncer de riñón o de vejiga, enviaremos al médico especialista en Anatomía Patológica para que examine la orina del paciente en busca de células tumorales. Si por el contrario sospechamos un cáncer de pulmón, lo que enviaremos serán esputos del paciente para su análisis.
PAAF (Punción aspiración con aguja fina)
Tras anestesiar la piel, un radiólogo guiado por ecografía o por TAC, va a ser capaz de localizar la tumoración sospechosa a analizar y de esta manera, va a pinchar con una aguja fina al paciente dirigiendo ésta hacia el tumor. El médico utilizará la aguja para aspirar una pequeña muestra de tejido que posteriormente será analizado por el patólogo.
Colonoscopia
Es una exploración esencial en el estudio del cáncer de colon. En este procedimiento, el médico pasa a través del recto un tubo flexible dotado de una luz y una cámara en su extremo y lo va a dirigir por el interior del colon del paciente. Esta técnica permite la posibilidad de obtener histología y de asegurar la localización del tumor. Así mismo, es de gran utilidad para el seguimiento de los pacientes con cáncer de colon ya que es capaz de detectar y extirpar lesiones premalignas y vigilar la aparición de recidivas locales del cáncer de colon. Los pacientes pueden solicitar una suave sedación durante la exploración.
Broncoscopia
Es una técnica esencial para el diagnóstico y estadificación del cáncer de pulmón. En este procedimiento, el médico pasa un tubo delgado y flexible con una luz en el extremo a través de la boca o de la nariz del paciente, a lo largo de la tráquea y dentro del árbol bronquial de los pulmones. El tubo permite que el médico vea el interior de los pulmones. Unos pequeños instrumentos que van por dentro del tubo pueden extraer muestras de tejido o líquido, para que el patólogo pueda examinarlas posteriormente. Los pacientes suelen recibir una leve anestesia o sedación durante la exploración.
Esofagogastroscopia
Es una técnica muy similar a las anteriores que cuenta con una alta utilidad en el diagnóstico, control postquirúrgico y seguimiento de los pacientes con cáncer de esófago o de estómago.
Laparoscopia
Es un método muy útil para la exploración de la cavidad abdominal. Consiste en introducir a través de 2 ó 3 pequeños orificios sobre la piel del abdomen, una pequeña cámara con luz, un palpador y un insuflsor de aire para evitar el colapso de las vísceras. Permite detectar implantes peritoneales y obtener histología en casos de tumores de origen desconocido con afectación peritoneal.
Toracoscopia
Consiste en introducir en la pared torácica a través de un pequeño corte en la piel, una cámara de vídeo que permite examinar el interior del pulmón. Los pacientes requieren anestesia general para este procedimiento, aunque el tiempo de recuperación es escaso. Permite la toma de biopsias de ganglios y tejido tumoral pulmonar o de la pared torácica accesible.
Mediastinoscopia
Consiste en el examen visual y toma de biopsia de los ganglios linfáticos del centro del tórax (mediastino) a través de una pequeña incisión que se realiza en la parte superior del esternón. Éste procedimiento también requiere anestesia general.
Una vez que se localiza y se estadifica el cáncer, los médicos pueden proceder con el tratamiento. Aquí, como en cada etapa de la atención oncológica, el diagnóstico por imágenes es de fundamental importancia.
Las técnicas de diagnóstico por imágenes se pueden usar para controlar la terapia, lo que permite a los médicos calcular el éxito del plan terapéutico desde el principio. Poder controlar la eficacia de un tratamiento al principio significa que se puede hacer un cambio en el curso apenas sea necesario, lo cual permite un ahorro de tiempo crucial en la lucha contra el cáncer y es un factor que mejora la calidad de vida durante y después del tratamiento. Las técnicas de diagnóstico por imágenes pueden demostrar si la terapia seleccionada resulta eficaz en un paciente y, de no ser así, puede ayudar a los médicos a elegir una estrategia más adecuada. Ya sea que se realice radioterapia, quimioterapia o ambas, el diagnóstico por imágenes puede medir su eficacia al demostrar cómo responde a ellas el tumor. (Figura 8)
 Figura 8. Control de la enfermedad
Figura 8. Control de la enfermedad
Con este fin, se han desarrollado varios modelos de criterios de respuesta, de los cuales el que más se usa es el modelo RESIST (Criterios de evaluación de respuesta en tumores sólidos); un conjunto de reglas publicadas que define cuándo los pacientes con cáncer mejoran (responden), permanecen igual (estabilización) o empeoran (avance). Antes de comenzar el tratamiento se realiza un estudio inicial, con el que se compararán estudios posteriores. Una vez que comienza la terapia, se usan diversas técnicas de diagnóstico por imágenes para determinar su efecto.
Cuando el curso de tratamiento finaliza, se realiza una exploración final para evaluar si la respuesta del cáncer al tratamiento fue completa, parcial o estable. La información sobre la respuesta al tratamiento es esencial para los médicos ya que pueden usarla para planear los próximos pasos, es decir, si el paciente necesita tratamiento adicional o, en el mejor de los casos, la atención de seguimiento si se han destruido los tumores.
La respuesta al tratamiento tradicionalmente se controla a través de la medición de las dimensiones del tumor primario y las dimensiones de varios nódulos linfáticos y anomalías, y la comparación de esas dimensiones con las imágenes originales previas al tratamiento. Además, ciertas herramientas de diagnóstico por imágenes pueden mostrar el metabolismo del tumor, información muy importante en la planificación del tratamiento.
El diagnóstico por imágenes se utiliza para evaluar la respuesta al tratamiento en gran parte usando el tamaño o la recidiva del cáncer. También se utiliza para controlar los posibles efectos secundarios de la terapia y las intervenciones terapéuticas. El diagnóstico por imágenes convencionales, como la radiografía, la ecografía, la tomografía computarizada (TC) y la imagen por resonancia magnética (IRM) utilizan mediciones para evaluar la respuesta o el avance. La respuesta por lo general se clasifica como “enfermedad progresiva”, “enfermedad estable”, “respuesta parcial” o “respuesta completa” al tratamiento.
El diagnóstico por imágenes funcionales y moleculares incluirán la evaluación del metabolismo del tumor y, de este modo, predecirán la respuesta a una terapia en particular. El diagnóstico por imágenes funcionales y moleculares es cada vez más popular en la atención del cáncer. Estas técnicas usan productos de contraste o marcadores biológicos, que son sustancias que por lo general se ingieren o inyectan y se usan para resaltar ciertos tejidos del cuerpo o moléculas biológicas. Cuando se visualizan con herramientas de diagnóstico por imágenes como la TC, la IRM y la tomografía por emisión de positrones (PET), pueden mostrar la actividad celular y los procesos moleculares en los organismos, incluidos los tumores. Una vez que los médicos conocen la naturaleza de un tumor y cómo interactúa con el resto del cuerpo, pueden definir con más facilidad qué terapia puede ser la más adecuada y eficaz[9].
Otra función del diagnóstico por imágenes en el tratamiento del cáncer es facilitar la administración de la terapia. Los agentes radiactivos (radioterapia) o químicos (quimioterapia) se utilizan con mucha frecuencia en el tratamiento, y el equipo médico desea estar lo más seguro posible de que estos alcancen sus objetivos sin dañar los órganos o tejidos circundantes.
Estas terapias requieren un nivel de precisión muy alto, y los oncólogos, independientemente de que sean oncólogos radioterapeutas o clínicos, cirujanos o médicos de medicina nuclear, dependen cada vez más en el personal con habilidades específicas de diagnóstico por imágenes para que los guíen durante sus intervenciones.
El diagnóstico por imágenes se usa para guiar el tratamiento del cáncer de varias maneras. Los oncólogos radioterapeutas lo usan para determinar la ubicación del cáncer y posicionar de manera correcta el haz de radiación. Los médicos especialistas en medicina nuclear usan el diagnóstico por imágenes para rastrear la actividad de radiofármacos en el cuerpo y determinar si están alcanzando su objetivo con precisión y en cantidad suficiente. Además, ahora hay equipos de diagnóstico por imágenes en muchas salas de operación quirúrgica. Hay muchos ejemplos de cómo la TC o la IRM se pueden usar para guiar el tratamiento. Los neurocirujanos por lo general usan imágenes tridimensionales de todo el cerebro para planear la cirugía en detalle, y los cirujanos utilizan cada vez más imágenes tridimensionales durante sus intervenciones en la cirugía de hígado[10].
Después de la cirugía, las imágenes de TC permiten a los médicos asegurarse de que el tumor ha desaparecido. En la radioterapia, es cada vez más común guiarse con imágenes para mejorar la seguridad. La cirugía guiada por imágenes basada en TC o IRM prequirúrgicas se ha vuelto popular especialmente en la cirugía de cerebro y se usa muy a menudo para la resección de tumores cerebrales. La planificación de la radioterapia también se basa en imágenes de TC para que el tumor reciba dosis suficientes de radiación y, a su vez, para controlar la dosificación a fin de preservar órganos vitales. La terapia guiada por imágenes puede mejorar el resultado del tratamiento y reducir el riesgo de complicaciones. Por lo tanto, los radiólogos son responsables de controlar el tratamiento y ayudan a que la terapia se administre de la manera más precisa y segura posible. Además, a veces realizan el tratamiento ellos mismos. Estas actividades en realidad han dado lugar a toda una rama de la radio una rama de la radiología: la radiología intervencionista.
En los últimos años, un número cada vez mayor de terapias guiadas por imágenes ha ampliado el rango de opciones de tratamientos contra el cáncer.
La radiología intervencionista, una subespecialidad de la radiología, se ha estado desarrollando desde principios de la década de los setenta, y se han establecido muchas técnicas guiadas por imágenes, en especial con respecto al tratamiento del cáncer. Estas técnicas son mínimamente invasivas, lo que significa que se pueden realizar mediante una pequeña incisión y, por lo tanto, implican estrés físico mínimo. La ventaja de estas técnicas es que plantean poco riesgo para el paciente; mucho menos que la cirugía convencional que por lo general requiere incisiones más grandes. Generalmente usan ecografías, radiografías, TC o IRM para guiar la aplicación de radiofrecuencias (RF) o temperaturas extremas, que hacen que el tumor se reduzca.
El tratamiento se administra mediante un tubo pequeño o catéter, que es guiado por un radiólogo usando imágenes en tiempo real para destruir el tumor sin dañar los tejidos circundantes. Los procedimientos terapéuticos guiados por imágenes se pueden usar en muchos casos: los pacientes con cáncer de cerebro, pulmón o renal son tratados cada vez con mayor frecuencia de esta manera. Como indica el profesor Hricak[11], hay diversas opciones posibles que se pueden usar para tratar distintos cánceres. La embolización consiste en obstruir los vasos sanguíneos que alimentan un tumor hasta que se reduzca y muera. La embolización no solo se usa para tratar el cáncer de hígado, sino también el de huesos y pulmón. Los caté- teres también transportan agentes químicos al lugar del tumor y liberan agentes que consumirán el tumor. Los radiólogos también pueden administrar radiación por sí mismos, por ejemplo, en un tratamiento llamado radioterapia interna selectiva (SIRT), mediante la inyección de pequeñas microesferas de material radiactivo directamente en las arterias que irrigan al tumor. También realizan comúnmente la ablación por radiofrecuencia, que usa ondas electromagnéticas (de radio) combinadas con una ecografía o una radiografía, para destruir metástasis pulmonares o hepáticas, como también cánceres renales.
La ventaja de las terapias mínimamente invasivas guiadas por imágenes es que pueden reducir el riesgo de complicaciones y acortar las estadías de los pacientes internados. Además, son una alternativa excelente a la cirugía para los pacientes que están muy enfermos, se niegan a someterse a cirugía o cuyo cáncer no se puede extirpar quirúrgicamente. Los médicos pueden recomendar a los pacientes a qué tratamiento deberían someterse después de considerar toda la información y reunir toda la experiencia según cada caso.
El tipo de cáncer, la historia clínica del paciente y la disponibilidad de los recursos determinarán la elección de la terapia. El radiólogo intervencionista generalmente usará el diagnóstico por imágenes para guiar un catéter o una aguja hasta el lugar de tratamiento para administrar un agente terapéutico. Por ejemplo, en un método llamado ablación térmica, se usa el diagnóstico por imágenes para guiar una aguja hasta un tumor y luego se aplican temperaturas extremas través de la aguja para destruirlo. La ablación térmica se puede usar para tratar cánceres en el riñón, el hígado o el pulmón, entre otros lugares. En la embolización de la arteria hepática, un tratamiento para tumores de hígado, el diagnóstico por imágenes se usa para guiar el catéter hasta la arteria hepática, y luego se inyectan partículas para bloquear el flujo sanguíneo hasta los tumores; algunos médicos también pueden elegir inyectar un agente quimioterapéutico o partículas que emiten radiación. (Figura 9)
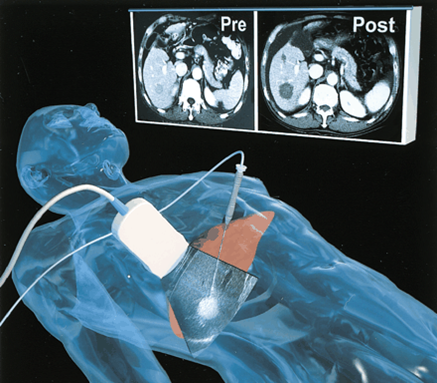
Figura 9. Radiología intervencionista.
La PET o tomografía por emisión de positrones es una técnica de imagen que se utiliza preferentemente en los campos de la Cardiología, la Neurología y la Oncología con fines diagnósticos.
El objetivo de esta técnica es estudiar la actividad metabólica y el flujo sanguíneo en diversos tejidos, lo que se consigue con distintos radionúclidos de vida corta, emisores de positrones producidos en un ciclotrón. (Figura 10)
Figura 10. PET TAC
En el caso de la aplicación en oncología, habitualmente se utiliza un metabolito denominado desoxi-glucosa marcado con 18-flúor que tiene una captación similar a la de la glucosa. Como este metabolito se acumula en la célula tumoral con más intensidad que en la normal por su mayor transporte y permanencia, ello hace posible la detección de neoplasmas por su mayor densidad de imagen debido a que las células tumorales emiten más radiación que el entorno[12].
El equipo para su realización consta de los siguientes bloques funcionales:
Una vez producido, el radionúcleo del que se trate debe ser administrado dentro de un intervalo de tiempo no superior al de la vida media del mismo que no debe ser superior a las dos horas. Esto permite el uso del radionúclido en cámaras de positrones instaladas a distancia en una isocrona inferior a los 60-90 minutos, lo que supone que un solo ciclotrón de unidad de radiofarmacia puede servir a varias cámaras.
En el caso de uso de la 18-FDG la adquisición de las imágenes se realiza a los 45 y 60 minutos post-inyección. En este momento la mayor parte de la FDG se encuentra en los tejidos con bajas concentraciones de glucosa-6-fosfatasa: tejido cerebral, miocardio, músculo esquelético y tumores. La actividad ha alcanzado un nivel estable y refleja las tasas de glicolisis de los diversos tejidos. El análisis de las imágenes puede realizarse de un modo visual, semicuantitativo o cuantitativo.
Los estudios con O15 y 18-FDG, evidencian en el tejido tumoral una disminución del cociente metabólico (consumo de oxígeno/glucosa), que indicaría una desproporción entre el metabolismo glucídico y el consumo de oxígeno en el tejido tumoral en el sentido de menor consumo de oxígeno con respecto a la glucosa utilizada, lo que sugiere un aumento de la glicolisis anaeróbica en dicho tejido.
En la célula tumoral la glucosa es transportada con mayor rapidez, existiendo mayor necesidad de la misma y al mismo tiempo mayor glicolisis anaeróbica, porque el aporte de oxígeno no crece tanto como el número de células. Ello induce a que la 18-FDG se acumule más en las células tumorales por el aumento de transporte de la misma hacia dentro de la célula tumoral.
En el interior de las células la 18-FDG es fosforilizada por acción de la enzima hexoquinasa pasando a FDG-6-fosfato, siendo la reacción reversible por efecto de la glucosa-6-fosfatasa. El aumento de la actividad de la hexoquinasa y la reducción de la glucosa-6-fosfatasa, inducidos por la transformación maligna determina una acumulación preferencial y atrapamiento de FDG-6-fosfato que a partir de aquí no sigue las vías metabólicas de la glucosa (glicolisis y gluconeogénesis).
Existe además cierta relación entre la celularidad o tasa de proliferación y el grado de malignidad del tumor con la tasa glucolítica. A este respecto la 18-FDG sirve como indicador de la mayor transcripción de genes asociados con la glicolisis.
Hay que señalar que la aniquilación de los positrones emitidos por la 18-FDG dan lugar a una radiación de fotones que son los que captan los detectores de la cámara PET.
Por otra parte es importante subrayar que la 18-FDG es captada también por macrófagos, tejidos de granulación y células inflamatorias lo que da lugar a dificultades para distinguir entre tejido tumoral y tejido reactivo inflamatorio, debiendo utilizarse distintos patrones de captación de la 18-FDG para dicha distinción.
La PET se puede utilizar en Oncología con fines diagnósticos para varios propósitos:
Se ha utilizado preferentemente en cabeza y cuello, pulmón, tumores de mama (diagnóstico, detección de ganglios y otras metástasis) y colon-recto (especialmente para detectar recurrencias), así como también los linfomas y melanomas.
La posibilidad de realizar estudios de cuerpo completo ha promovido la utilización de esta tecnología en este campo.
 Por otra parte los radionúclidos emisores de positrones (18-FDG u otro) pueden ser utilizados en estudios a realizar con gammacámaras convencionales y SPECT de 2 cabezas equipándolas con colimadores especiales para la energía de 511 Kev. Esta eventual utilidad puede mejorar adicionalmente las posibilidades de rendimiento de las instalaciones y operaciones para la producción de radionúclidos. (Figura 11)
Por otra parte los radionúclidos emisores de positrones (18-FDG u otro) pueden ser utilizados en estudios a realizar con gammacámaras convencionales y SPECT de 2 cabezas equipándolas con colimadores especiales para la energía de 511 Kev. Esta eventual utilidad puede mejorar adicionalmente las posibilidades de rendimiento de las instalaciones y operaciones para la producción de radionúclidos. (Figura 11)
Figura 11. PET TAC
Los problemas tecnológicos para conseguir una imagen correcta de la zona analizada por la PET son múltiples; a continuación se enumeran algunos de los más importantes:
DECAIMIENTO RADIOACTIVO: es la pérdida de actividad del radio-isótopo por lo que las exploraciones deben ser realizadas dentro de un intervalo de tiempo óptimo.
DISPERSIÓN por efecto Compton, en el que los fotones al cambiar su momento por pérdida de energía salen con distinto ángulo que los que no han sido dispersados.
ATENUACIÓN: por pérdida de energía de los fotones en su camino hacia los detectores de centelleo.
SUCESOS DEBIDOS AL AZAR: coincidencia por azar de 2 fotones gamma que se originan de eventos diferentes, dando lugar a ruido que hay que atenuar.
TIEMPO MUERTO de la cámara.
NIVEL DE GLUCOSA EN EL ENFERMO: no se debe realizar la prueba sin conocer el nivel de glucemia ya que se podrían distorsionar los resultados.
PESO DEL ENFERMO: es necesario conocerlo para utilizar la fórmula del SUV (ver más adelante) ya que interviene como denominador.
CONTENIDO EN GRASA DEL ENFERMO: es importante tener en cuenta este parámetro ya que la grasa acumula poca FDG y distorsionaría los resultados de las cuantificaciones.
TAMAÑO DEL ROI (REGION OF INTEREST) que equivale a la región lesional analizada.
RESOLUCIÓN DEL SCANNER o sensibilidad de la cámara que es la capacidad discriminatoria entre 2 puntos próximos de la Región de interés.
EFECTO DE VOLUMEN PARCIAL en el que influye el diámetro de la lesión y la actividad circundante.
De la complejidad técnica expuesta puede inferirse la existencia de dificultades a la hora de alcanzar altos niveles de precisión y exactitud diagnóstica.
El uso de fantomas, la introducción de fórmulas matemáticas con constantes basadas en la experiencia y diferentes refinamientos informáticos en desarrollo actual, están contribuyendo a mejorar precisión, exactitud y poder de resolución en esta tecnología, que aún no ha alcanzado un nivel estable de logro técnico.
En todo caso, el análisis de las imágenes obtenidas puede realizarse de modo visual (cualitativo), cuantitativo y semicuantitativo. Este tipo de análisis es particularmente útil en la diferenciación entre lesiones benignas y malignas.
Para la resolución de los problemas existentes en las mediciones cuantitativas o semicuantitativas de la actividad de la 18-FDG en el enfermo/zona tumoral se han propuesto los siguientes índices:
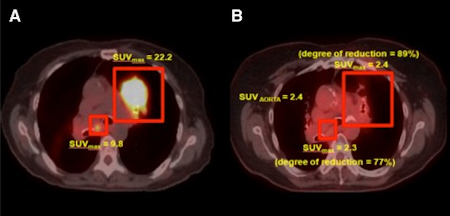
Figura 12. SUV
La combinación de la información metabólica proporcionada por la PET y la anatómica de la CT ofrece muchas ventajas, ya que facilita la interpretación de las imágenes y puede ofrecer datos muy útiles a la hora de plantear los tratamientos quirúrgicos y de radioterapia. En la re-estadificación, la PET-TAC ayuda a delinear la localización y extensión de la enfermedad recurrente en pacientes con cambios anatómicos complejos tras la radioterapia[15].
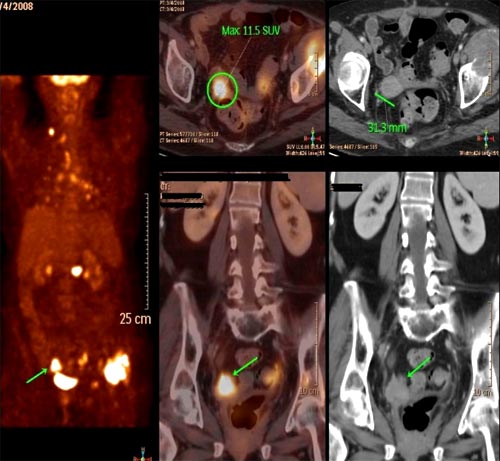
Importante impacto en el manejo terapéutico individual al detectar segundos tumores primarios y metástasis a distancia con gran exactitud[16]. (Figura 13)
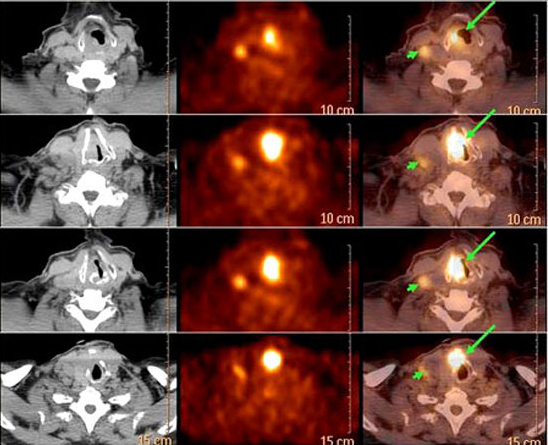
Figura 13. PET TAC cabeza y cuello
En el cáncer de colon y recto el PET-FDG es de gran utilidad para la evaluación especialmente en reestadificación y en pacientes con sospecha de recurrencia, puede ser muy útil para distinguir entre cicatriz y tumor recurrente, así como para observar la respuesta al tratamiento quimioterápico de las metástasis hepáticas y diagnosticar metástasis hepáticas operables[17].[18],[19]. (Figura 14)
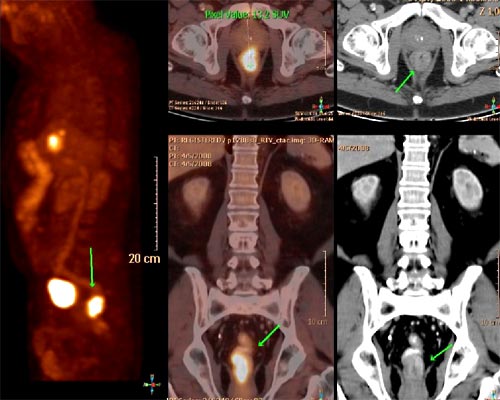
Figura 14. PET TAC Cáncer de recto
El PET en cáncer de mama sólo se usa después del diagnóstico de éste, y cuando otros exámenes como Resonancia Magnética o TAC no suministrar suficiente información[20].
Puede solicitarse para descartar progresión de la enfermedad después de los tratamientos, recidivas o sospecha de no respuesta[21]. No para detectar o diagnosticarlo. (Figura 14 y 15)
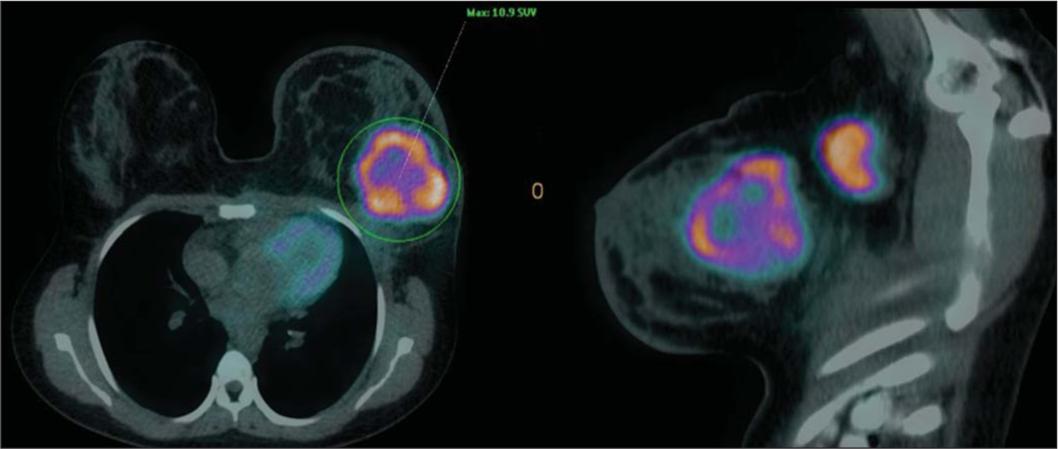
Figura 14. Correlación PET/TAC en cáncer de mama
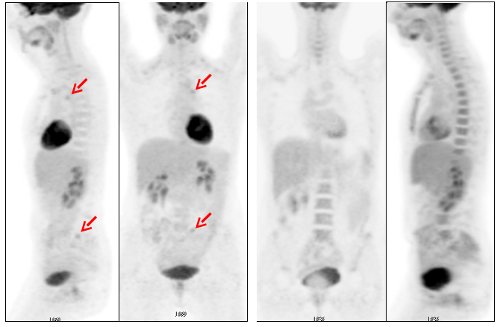
Figura 15. Detección de recidiva
Actualmente se indica en uso de PET en la evaluación de Nódulo Pulmonar Solitario indeterminado, así como en la evaluación inicial del cáncer de pulmón de cara a decisiones terapéuticas: cirugía, quimioterapia y radioterapia. Reestadificación así como evaluación de respuesta terapéutica y para la diferenciación de cicatriz con recurrencia[22],[23]. (Figura 16)
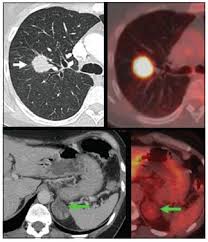
Figura 16. PET cáncer de pulmón
El NPS se define como una opacidad radiológica única, esférica, circunscrita, de diámetro máximo ≤30mm, rodeada en su mayor parte por pulmón aireado y no asociada a atelectasia, agrandamiento hiliar o derrame pleura, que puede ser encontrado en RX Torax o en TAC realizado para el estudio de otras patologías.
Una de las principales indicaciones de la PET-TC con 18F-desoxi-D-glucosa. La sensibilidad media para NPS sólidos de 10-15mm es 0,93 (IC 0,90-0,95), y la especificidad media es 0,80 (IC 0,74-0,85)[24]. Y permite seleccionar la localización más rentable y accesible para la toma de biopsia, incluso ayudar a la planificación terapéutica: cirugía o radioterapia. Se requiere una confirmación histológica[25]. (Figura 17)
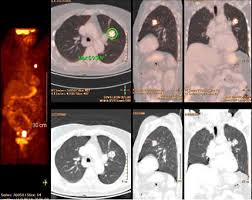
Figura 17. PET con NPS
1. METÁSTASIS HEPÁTICAS DE DISTINTOS TUMORES
En metástasis hepáticas de distintos tumores los resultados de la exactitud diagnóstica del TAC y de la Ecografía (93%) son similares a los de la PET (98%). En linfomas la sensibilidad del estudio planar escintigráfico con Galio es del 95%, también comparable a la de la PET (100%)[26].
2. DIFERENCIACIÓN ENTRE C. DE PÁNCREAS VS PANCREATITIS CRÓNICA
En la diferenciación de cáncer de páncreas respecto a la pancreatitis crónica no hay estudios comparativos, pero es de señalar que la PET proporciona unas cifras muy aceptables de sensibilidad (95 a 92%) y de especificidad (90 a 82%) dependiendo de los valores publicados por los distintos autores. Hay que tener en cuenta que con los medios habituales es muy difícil la diferenciación entre estos dos procesos[27].
3. MELANOMAS
En melanomas no existen estudios comparativos, la PET en metástasis proporciona unas cifras destacables de exactitud diagnóstica del 100%, sensibilidad entre 73 al 100% y especificidad entre 77 al 100%, dependiendo de los estudios[28].
4. CARCINOMAS DE OVARIO
En diagnóstico de carcinomas de ovario, sólo se ha comparado la PET con el TAC, siendo bastante superior aquélla en todas los parámetros diagnósticos (sensibilidad del 89% para la PET y del 72% para el TAC)[29]. Sin embargo en recurrencias de este tipo de cáncer hay varios estudios, proporcionando la PET sensibilidades entre el 55 y el 94% y especificidades entre el 88 y el 100%, superiores a las del TAC que ofrecen una sensibilidad del 55% y una especificidad del 75%, e inferiores a la de los marcadores tumorales con sensibilidad del 73% y especificidad del 100%.
La colina es un precursor de la fosfatidilcolina, un fosfolípido necesario para la síntesis de la membrana celular. Los tumores malignos se caracterizan por presentar un incremento en la síntesis de membranas celulares, reflejando indirectamente la proliferación celular, mostrando elevada captación de colina en relación a los tejidos sanos, permitiendo la identificación y localización de las lesiones.
La distribución y concentración de este radiofármaco en los tejidos sanos y patológicos se produce de manera inmediata a la inyección, generando ventajas en el estudio de lesiones en relación con el sistema excretor (próstata, uroepitelio, etc.), ya que la captación es previa a la excreción urinaria del radiofármaco. Es necesario realizar el estudio con técnicas dinámicas, sólo posible en equipos de PET-TC de última generación[30].
En el cáncer de próstata se ha demostrado que el PET-TC con 18F-Colina es claramente superior a la 18F-FDG, tanto en la valoración del tumor primario como en la detección de recidiva local o metastásica y particularmente en la evaluación de la recaída bioquímica (en el caso de aumento de PSA), con imágenes convencionales negativas[31],[32].
El estudio PET-TC con 18F-Colina se utiliza en pacientes con cáncer de próstata[33], carcinoma hepatocelular o tumores cerebrales. Está en desarrollo y en evaluación su utilización en otros tumores, como patologías ginecológicas, cáncer colorrectal, etc. (Figura 18)

Figura 18. PET TAC Colina en cáncer de próstata
Durante décadas la TC ha sido la prueba de elección en el paciente oncológico, proporcionando información morfológica de las alteraciones que conlleva la enfermedad tumoral. Sin embargo, la aparición de la tomografía por emisión de positrones (PET) en los años noventa supuso un cambio fundamental en el manejo de estos pacientes al aportar una valiosísima información acerca del metabolismo de la enfermedad. A pesar de ello, uno de los principales inconvenientes de la PET ha sido su falta de resolución anatómica, que impedía en muchas ocasiones localizar adecuadamente las lesiones que detectaba de forma precoz en comparación con el resto de pruebas de imagen. Han sido varios los intentos de paliar este defecto con el fin de aumentar el rendimiento diagnóstico de la prueba PET.
El primero de ellos fue la llamada "fusión visual", que permitía valorar de forma separada y por 2 expertos los datos de ambas exploraciones, lo que conllevaba muchas inexactitudes diagnósticas. Más recientemente se desarrollaron potentes sistemas de "fusión por software" que permitían integrar en una sola estación de trabajo la información aportada de forma independiente por un equipo de TC y otro de PET. A pesar de la mejora en la correlación de las imágenes, el hecho de que los estudios fuesen realizados al mismo paciente en diferentes tiempos y en diferentes equipos conllevaba también importantes defectos metodológicos que impedían obtener una imagen de fusión anatomometabólica de calidad diagnóstica. El paso definitivo para solucionar este problema lo dio el equipo de investigadores dirigidos por el Prof. Townsend (Universidad de Pittsburgh) el cual consiguió en 1998 diseñar un único equipo que integraba una TC y en cerca del 30-40% de los casos1. Esta irrupción de los equipos integrados se ha extendido a la medicina nuclear convencional con la aparición de los modernos sistemas SPECT-TC y tiene su siguiente desafío en los equipos PET-RM y SPECT-RM que en pocos años se implantarán en los departamentos de diagnóstico por imagen[34].
A esta revolución tecnológica que ha supuesto la PET-TC se ha unido, desde su implantación en el ámbito hospitalario en 2001, la necesidad de integración de los especialistas de medicina nuclear y radiodiagnóstico en la interpretación de los estudios obtenidos. Estos equipos utilizan en su diseño lo último en tecnología PET y TC, lo que permite obtener estudios de similar calidad diagnóstica a la que se obtendría por separado, especialmente en el caso de la TC. Hay equipos en el momento actual que incorporan una TC de 64 detectores junto a sistemas PET que proporcionan una resolución de aproximadamente 2 mm. Por tanto, el correcto uso de los equipos PET-TC hace innecesaria la realización de otros estudios de TC, lo que conlleva la consiguiente optimización desde el punto de vista de protección radiológica y del manejo clínico de los pacientes. Frente a la disyuntiva de hace unos años entre usar equipos PET o PET-TC, en el momento actual se asiste a la controversia entre el modo de utilizar los equipos PET-TC: si sólo en su vertiente PET o de forma completa sacando el máximo rendimiento de las prestaciones diagnósticas que ofrecen la PET y la TC. La evolución tecnológica de las técnicas híbridas hará que en poco tiempo esta última controversia quede diluida y el dilema se centre entre una PET de última generación[35].
Desde entonces, la implantación de estos equipos híbridos en el ámbito hospitalario ha sido tan importante que se han convertido en la exploración diagnóstica de referencia en oncología. Por ello es fundamental que la tecnología híbrida se integre en departamentos de diagnóstico por imagen que permitan sacar el máximo rendimiento posible a ambas exploraciones, siendo necesario que la información final que se proporcione al especialista solicitante sea única y conjunta de la aportada por la imagen anatómica y metabólica. Un valor añadido de este trabajo conjunto de los especialistas de imagen es la posibilidad de obtener estudios de fusión PET-RM tan importantes en neurooncología o como serán en poco tiempo en patología osteoarticular[36].
La PET-TC es la prueba de imagen diagnóstica de elección para un gran número de procesos neoplásicos, como el cáncer de pulmón, linfomas, cáncer colorrectal, tumores de cabeza y cuello, melanomas y cáncer de mama, entre otros. Su introducción en el algoritmo diagnóstico ha conllevado en muchos tumores una mejora en la supervivencia al facilitar la aplicación de forma precoz y adecuada de las modernas dianas terapéuticas disponibles en la actualidad. Ha permitido reducir en un porcentaje importante de casos las secuelas postratamiento mejorando la calidad de vida de los pacientes, en especial tras los diversos tratamientos radioterápicos. Estamos ante lo que los expertos denominan "oncología guiada por PET-TC". Pero todas estas expectativas dependen de cómo se use e integre la prueba en el ámbito hospitalario. El espectacular desarrollo tecnológico vivido en los últimos años ha permitido que en el momento actual se dispongan de equipos PET-TC que aúnan lo mejor del equipamiento de la PET y de la TC. Sin embargo, y a pesar del esfuerzo desarrollado, la introducción de la prueba en el ámbito asistencial no ha logrado alcanzar el nivel de colaboración necesaria entre los especialistas de medicina nuclear y radiodiagnóstico que permita obtener el máximo rendimiento a esta potente herramienta diagnóstica. El clásico distanciamiento de ambas especialidades ha conllevado con frecuencia renunciar a las grandes posibilidades diagnósticas del componente TC. Realizar una exploración PET-TC basándose principalmente en la información proporcionada por la imagen metabólica, obviando los datos morfológicos por no aplicar protocolos diagnósticos como el uso de contrastes (intravenosos y orales) o la utilización de dosis adecuadas de voltaje en la obtención de las imágenes TC, significa utilizar la técnica de forma incompleta. No se trata de aportar datos morfológicos básicos (como la existencia de un aneurisma o la presencia de litiasis renal), sino de evitar la realización de una nueva exploración de TC tras la prueba de PET-TC. Esto es fundamental en los tumores como los linfomas, en los que es necesario utilizar la PET-TC como herramienta que permita valorar la eficacia de los tratamientos administrados, especialmente en la población pediátrica. El informe final remitido al especialista debe contener toda la información que pueda obtenerse de ambas pruebas por separado y tras el análisis conjunto de éstas. Los especialistas de medicina nuclear debemos acostumbrarnos a informar como patológicos, desde el punto de vista oncológico, estudios sin lesiones captantes de FDG pero con alteraciones en las imágenes anatómicas. Cuanto más completa sea la información que acerca de la enfermedad se le transmita al médico solicitante, mayor será la confianza que tendrá en la técnica y mayor el beneficio que en términos de supervivencia y calidad de vida se le proporcionará al paciente[37].
La tecnología híbrida se ha extendido también al mundo de la medicina nuclear convencional con la aparición de los sistemas SPECT-TC. En pocos años seremos también testigos de una nueva revolución en la imagen con los modernos equipos PET-RM y SPECT-RM que en el momento actual están en plena fase de desarrollo. Todo ello hará necesaria la creación de la figura del "especialista en diagnóstico por imagen" que podrá evaluar de forma individual cualquier técnica diagnóstica, tanto metabólica como estructural. En este sentido, las sociedades europeas de medicina nuclear y radiología han empezado a colaborar estrechamente en la elaboración de un documento único23 que permita establecer las bases para la futura formación de estos especialistas. Mientras ello llega, es necesaria la máxima colaboración entre los especialistas de medicina nuclear y radiodiagnóstico a la hora del manejo de los modernos y sofisticados equipos PET-TC. La creación de los departamentos de diagnóstico por imagen es la plataforma ideal para realizar esta colaboración, tan necesaria para el correcto manejo del paciente oncológico.
1. Limitaciones de la imagen metabólica en oncología: captaciones fisiológicas
La FDG, como análogo de la glucosa, nos proporciona información acerca del metabolismo glucídico, así como sobre la distribución de la glucosa en el cuerpo. Por tanto, algunas de las captaciones fisiológicas de la FDG se localizan en el córtex cerebral, el miocardio, la musculatura, las mucosas y el sistema gastrointestinal. Al no ser propiamente glucosa, la FDG además será eliminada por el sistema excretor. Todo ello conlleva que la posible presencia de patología tumoral en todas estas localizaciones puede quedar enmascarada por la captación normal de FDG. Esta limitación puede compensarse por la información que proporciona la TAC. (Figura 20)
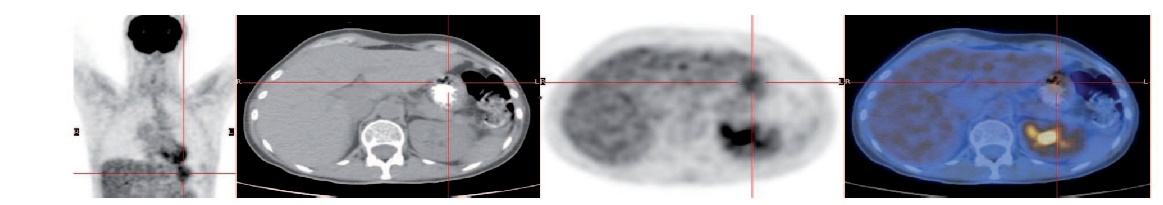
Figura 20. Captación fisiológica en PET TAC
2. Patología inflamatoria/infecciosa
La captación de FDG refleja la actividad celular. Ésta es mucho más intensa y evidente en el caso de los procesos malignos. Sin embargo, otras entidades, como la patología inflamatoria/infecciosa, provocan un incremento del metabolismo glucídico celular, especialmente a expensas de los macrófagos. Esta captación de la FDG es con frecuencia una fuente de resultados falsos positivos en las exploraciones PET. Aunque una adecuada metodología y la información clínica del caso pueden evitar esta circunstancia, en muchas ocasiones sólo la información aportada por la imagen de TC permite obtener un adecuado diagnóstico.
3. Lesiones de pequeño tamaño
A pesar de la progresión tecnológica de la PET en los últimos años, una de las limitaciones más importantes continúa siendo la resolución de los equipos y su capacidad para detectar lesiones de pequeño tamaño. Lejos quedan los equipos que eran incapaces de detectar lesiones por debajo de 1 cm, siendo ésta una barrera superada por la casi totalidad de los sistemas implantados en el ámbito hospitalario. En el momento actual se puede considerar que el límite de resolución de la imagen PET integrada en los equipos híbridos oscila entre 4 y 6 mm, habiéndose obtenido recientemente dispositivos que permiten detectar lesiones de hasta 2 mm de tamaño6. La investigación sobre nuevos detectores permitirá, en breve, conseguir que el límite de resolución se aproxime a los obtenidos por la RM7. Esta limitación técnica de la imagen PET se manifiesta con mayor intensidad en la patología torácica, siendo en muchas ocasiones la imagen de TC la única que permite detectar pequeñas lesiones metastásicas pulmonares.
4. Grado de diferenciación tumoral
La FDG permite obtener información de las lesiones tumorales de moderado/alto grado de actividad metabólica8. Cuanto más diferenciado o cuanto más lento es el ritmo de crecimiento celular en un tumor, menor actividad glucídica presenta y, por ende, mayor es la posibilidad de falsos negativos en la imagen de PET. El rendimiento diagnóstico de la PET-FDG suele ser bajo en patologías como el cáncer de próstata, los sarcomas de bajo grado, los tumores broncoalveolares, algunos adenocarcinomas bien diferenciados, los tumores neuroendocrinos o algunas estirpes celulares de bajo grado en linfomas no hodgkinianos. Aun cuando hay otros trazadores que permiten detectar el bajo grado histológico9, como la 11C-colina, la 11C-metionina, la 18F-timidina, la 18F-DOPA o la 68Ga-DOTA-NOC, por poner sólo algunos ejemplos, éstos no están disponibles en la mayoría de los centros con tecnología PET-TC. Estas limitaciones pueden ser compensadas en algunas situaciones clínicas por la información que proporciona la TC, como ocurre con frecuencia en el cáncer de próstata o en la detección de metástasis óseas de características blásticas.
El tratamiento radioterápico contribuye a la curación del cáncer. Su efecto depende de la dosis de radioterapia recibida y del tejido irradiado. A más dosis y más volumen irradiado, existen en general más probabilidades de control del tejido tumoral, pero también más probabilidades de daño sobre el tejido sano. El objetivo del tratamiento es administrar la máxima dosis posible sobre el tejido tumoral, con la máxima preservación del tejido sano adyacente. La intención es conseguir la mayor tasa de curación posible, con los menores efectos secundarios.
La administración correcta del tratamiento radioterápico requiere la sucesión de una serie de etapas que constituyen el denominado proceso radioterápico. El Real Decreto 1566/1998, de 17 de julio, por el que se establecen los criterios de calidad en radioterapia incluye en estas etapas clínicas la evaluación inicial del paciente , la decisión terapéutica , la localización ,el plan de irradiación, la simulación, la aplicación y el control del tratamiento, así como la evaluación final y el seguimiento.
Una vez tomada la decisión terapéutica, por la que se considera a un paciente subsidiario de recibir tratamiento radioterápico, es preciso “localizar” el volumen blanco (“diana”) a irradiar.
Hoy día esta localización se realiza en 3 dimensiones de forma rutinaria en nuestro medio, mediante la adquisición de una Tomografía Computerizada (TC). Esta TC, es hoy por hoy insustituible, dado que el diseño del plan de irradiación pasa por utilizar planificadores de radioterapia basados en el uso de las densidades electrónicas de dicho estudio[38]. Sobre las imágenes obtenidas del paciente en unas condiciones determinadas que puedan ser reproducibles en futuras sesiones de tratamiento, el oncológo radioterápico debe delimitar el GTV (“gross tumor volumen”) o volumen tumor macroscópico[39].
Una vez delimitado el GTV será preciso ampliar dicho volumen para incluir la enfermedad maligna subclínica que debe ser eliminada. Este volumen constituye el CTV (“clinical target volumen” o volumen blanco clínico) y debe ser tratado adecuadamente para alcanzar el objetivo de la terapia radical. Al CTV debemos añadirle un margen para tener en cuenta las variaciones en su posición, tamaño y forma, durante cada sesión o entre sesiones del tratamiento (IM margen interno); así como un margen que compense las imprecisiones y fallos de reproductibilidad en el posicionamiento del paciente y la alineación de los haces terapéuticos durante la planificación y a lo largo de las sesiones de tratamiento (SM margen de configuración). Con la combinación de dichos márgenes obtendremos el PTV (“Planning Target Volume” o volumen blanco de planificación).Es un concepto geométrico utilizado en la planificación de un tratamiento y se define para seleccionar los tamaños y configuraciones apropiadas de los haces , de modo que se asegure que la dosis prescrita es realmente administrada al CTV.
Por último debemos delimitar los órganos de riesgo (OAR “organs at risk”), con un margen combinado para definir un PRV (volumen de planificación del órgano de riesgo) que nos permita prever las posibles complicaciones de los tejidos sanos.
Una vez diseñado el PTV y prescrita una dosis al mismo, el oncólogo radioterápico determinará las restricciones de dosis al PRV. El radiofísico hospitalario posteriormente diseñará un plan de irradiación que cumpla dichas condiciones y que deberá aceptar el oncológo radioterápico, que será también el responsable de supervisar que sea aplicado y verificado correctamente.
Los sistemas de planificación y administración de tratamiento actuales, permiten diseñar los campos de irradiación y depositar la dosis prescrita de modo preciso sobre el volumen tumoral. Al conjunto de las diferentes técnicas que hacen posible este objetivo, se les denomina RT conformada. La RT conformada hace uso de las imágenes médicas en el proceso de planificación (principalmente imágenes TC), utiliza avanzadas herramientas digitales de cálculo dosimétrico y emplea estrictos procedimientos de control geométrico y dosimétrico. (Figura 21)
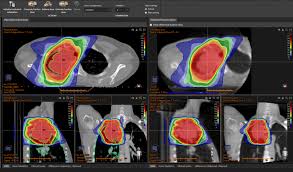
Figura 21. Planificación de radioterapia
La Tomografía por Emisión de Positrones (PET) con Fluoro-deoxi-glucosa (FDG), y especialmente los estudios híbridos PET-TC, juegan actualmente un papel muy importante en el estudio diagnóstico y la estadificación de lesiones malignas[40]. La fusión de los estudios metabólicos con los estudios estructurales ha mejorado la precisión diagnóstica de la PET en Oncología[41].
La planificación de la RT no se contempla en la ficha técnica de la 18F-FDG. Sin embargo, a la vista de la evidencia científica, la utilización de las imágenes y la información ofrecida por la PET para planificar los campos de RT se considera una de las indicaciones PET con mayor potencialidad[42].
La planificación de la radioterapia debe estar siempre basada en los métodos diagnósticos más exactos disponibles para determinar la extensión tumoral, por lo que en este sentido la PET-TC es útil en la planificación de la radioterapia en las localizaciones tumorales en las que ésta demuestre serlo. Utilizada en la planificación de la RT, su objetivo principal es contribuir a la mejor definición del volumen de tratamiento. El impacto que la PET-TC produce en radioterapia (RT) incide sobre la indicación del tratamiento (curativo o paliativo), la delimitación de los contornos del volumen tumoral, la variabilidad inter-observador en la planificación geométrica y, eventualmente, sobre la eficacia terapéutica.
Se encuentra en estudio la utilidad de la PET-TC en la planificación de RT, siendo esta una de las áreas clínicas con mayor beneficio potencial de la nueva tecnología en el futuro inmediato, hasta el punto de sustituir los métodos actuales basados en imágenes TC[43]. (Figura 22)
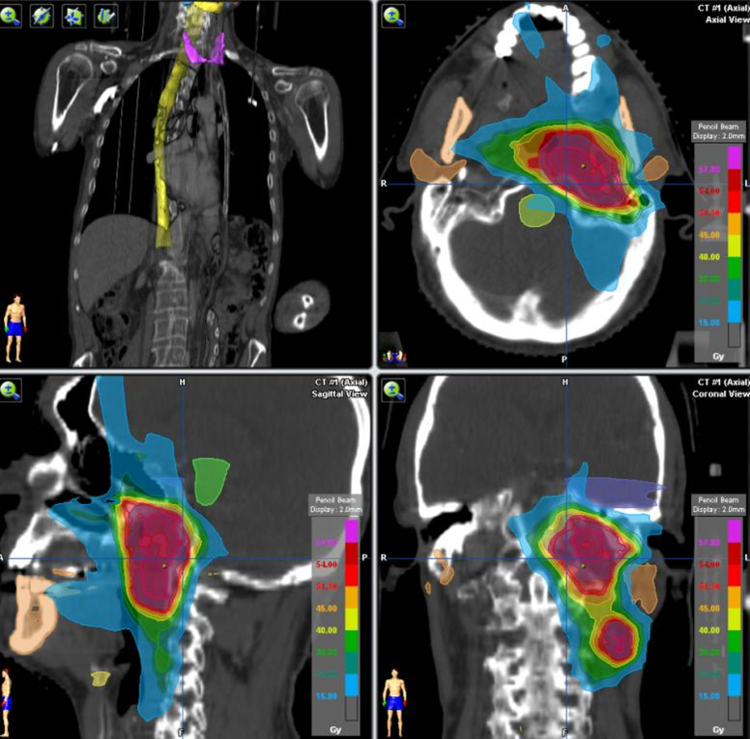
Figura 22. Planificación Radioterapia por PET TAC
La necesidad de un grupo multidisciplinar y unas recomendaciones comunes
La exploración PET-TC con la finalidad de planificar la RT es una de las exploraciones de diagnóstico por imagen más complejas. La utilización directa de las imágenes PET-TC en aplicaciones terapéuticas sin una evaluación crítica de sus limitaciones y sin una estandarización de los procedimientos puede conducir a resultados insatisfactorios. De ahí que una de las primeras tareas, antes de implantar estas técnicas en la rutina clínica, sea analizar los aspectos técnicos relevantes en la utilización de equipos PET-TC para la planificación de RT y proporcionar algunas recomendaciones de uso clínico.
En el proceso de adquisición de las imágenes PET-TC destinadas a la planificación de la radioterapia, la colaboración estrecha con los especialistas en medicina nuclear se hace imprescindible. Es fundamental tanto por el esfuerzo organizativo que supone, como por la necesidad de contar con una interpretación correcta de dichos estudios. El papel del radiofísico va a ser también fundamental por su implicación en el proceso de estandarización y en los controles de calidad destinados a un uso adecuado de las imágenes PET-TC, al igual que lo es en todo el proceso radioterápico.
Por todo lo expuesto, la colaboración multidisciplinar entre oncólogos radioterápicos, radiofísicos hospitalarios y médicos nucleares se hace imprescindible si pretendemos que el uso de las imágenes PET-TC suponga una herramienta de extremada utilidad.
Existen extensos documentos que recogen recomendaciones acerca del uso de la PET-TC en la planificación de la radioterapia, como las plasmadas por las sociedades europeas de Oncología Radioterápica y Medicina Nuclear ( EANM-ESTRO ) en un monográfico dedicado por la revista Radiotherapy & Oncology en septiembre de 201042. (Figura 23)

Figura 23. Equipo multidisciplinar
Dado que el procedimiento de la PET-TC en la planificación de RT implica a distintos servicios es necesaria la coordinación y colaboración de todos para su correcto desarrollo. El enfoque multidisciplinar requerirá un conocimiento de los aspectos críticos, así como algunas definiciones, de todas las especialidades involucradas, con la finalidad de que se eliminen los límites de conocimiento y se realice un abordaje integrado de dicho procedimiento.
Inicialmente tiene que definirse sobre qué tumores se va a iniciar dicho procedimiento y cuál será el proceso desde que el paciente es valorado por el Servicio de Oncología Radioterápica hasta que las imágenes son analizadas para la obtención de los volúmenes terapéuticos. Dado que la avidez metabólica es distinta, según el tumor y localización que estemos valorando, es recomendable analizar todos los factores implicados en un proceso tumoral antes de sumergirnos en otro.
Una vez definidos y consensuados los aspectos metodológicos de todo el proceso verificaremos que se dispone de las instalaciones y material necesario (láseres, tablero plano e inmovilizadores compatibles con los utilizados en el SORT, compatibilidad y conexión entre estaciones de trabajo del Servicio de Medicina Nuclear.
Siempre debe considerarse que el momento de realización del estudio PET-TC de planificación es una oportunidad ideal para verificar el estadio tumoral de un paciente.
En condiciones ideales, para reducir costes, demoras y radiación, la técnica estándar puede ser adquirida el mismo día en el que se realice el estudio PET-TC de planificación. Una vez verificada la ausencia de enfermedad a distancia se seguirá con el protocolo definiendo la hora del estudio PET-TC de planificación para que los técnicos responsables del posicionado del paciente y de la adquisición de la PET-TC, así como la enfermera que administre el contraste IV, se coordinen.
En relación con el momento de la obtención de la imagen PET para planificación, se recomienda que esta se realice lo más tarde posible (3-5 horas) tras la administración de la 18F-FDG ya que se ha demostrado que, en este periodo de tiempo, la actividad metabólica relativa en los procesos tumorales respecto al tejido normal es máxima por reducirse la actividad en los procesos fisiológicos e inflamatorios[44].
La herramienta habitualmente empleada en la adquisición de imágenes para la planificación de RT se denomina TC-Simulador y el proceso es conocido como TC-Simulación o Simulación Virtual. Se denomina así porque permite obtener imágenes del paciente en la posición “simulada” del tratamiento de radioterapia. Un TC-Simulador resulta de la combinación de:
Para emplear la PET-TC en el proceso de planificación de RT, se habrá de convertir la PET-TC en un PET-TC-Simulador. Esta transformación requiere de los siguientes elementos:
Preparación del paciente por parte de Oncología Radioterápica
La precisión del tratamiento radioterápico va a depender en buena medida de la posición del paciente y de la capacidad del equipo asistencial para re-posicionar diariamente al paciente a lo largo del curso del tratamiento.
Los factores que pueden limitar el correcto posicionamiento del paciente son:
Por ejemplo, la disfagia ocasionada por el crecimiento tumoral en oro- o hipofaringe ocasionará la acumulación de saliva en boca y orofaringe impidiendo mantener la posición supina con extensión cervical durante el tiempo necesario para la adquisición de imágenes PET. La comorbilidad respiratoria o cardíaca puede imposibilitar la posición supina por ocasionar una disnea intolerable.
El dolor puede ser el factor limitante para el mantenimiento de la posición del paciente. Es necesario prever esta eventualidad y ajustar la medicación para conseguir el control analgésico adecuado en el momento de la simulación.
Sea cual sea la posición del paciente, su eje longitudinal debe ser paralelo al eje longitudinal de la mesa de la PET-TC sin rotación en el plano axial en torno a este eje. Para conseguir esta alineación y ausencia de rotación axial, la sala debe disponer de un haz de luz láser sagital y dos haces de luz láser laterales, uno a cada lado de la sala, todos ellos alineados con los ejes del scanner[45]. (Figura 24)

Figura 24. Posicionamiento del paciente
El técnico de radioterapia debe situar los puntos de triangulación en el área anatómica de interés para el tratamiento, tatuar la piel del paciente en la localización precisa de estos puntos o marcar los accesorios de inmovilización (p. ej.: máscara termoplástica) si se encontraran en la posición de estos puntos. Para poder reproducir la alineación, es necesario tatuar sobre la piel o marcar sobre el accesorio de inmovilización algún punto adicional en el plano sagital.
El objeto ideal sobre el que efectuar una planificación de RT sería un sólido rígido (indeformable) e inmóvil. El cuerpo del paciente es deformable, externa e internamente, y móvil, voluntaria e involuntariamente. Para reducir los movimientos externos, voluntarios o involuntarios del paciente, se emplean en radioterapia diversos conjuntos de accesorios de inmovilización. Es muy aconsejable que estos accesorios vayan fijados al tablero plano y vayan también indexados (referenciados a una posición fija en el tablero) para reproducir exactamente su colocación durante la planificación y durante el tratamiento. La utilización de estos accesorios de inmovilización durante la adquisición de imágenes para la planificación se ha demostrado de gran utilidad para la reducción de artefactos de movimiento. Si los accesorios no se encuentran indexados y fijados al tablero de la mesa serán posibles movimientos de traslación (lateral y longitudinal) y rotación (sobre el eje vertical o viraje y sobre el eje longitudinal o alabeo). (Figura 25)

Figura 25. Sistemas de inmovilización en radioterapia
Preparación del paciente por parte de Medicina Nuclear
Se seguirá el protocolo de preparación, administración de la dosis de FDG y adquisición refrendado por la Sociedad Europea de Medicina Nuclear y Sociedad Española de Medicina Nuclear[46].
ABSOLUTAS:
RELATIVAS
2. DURANTE SU ESTANCIA EN EL SERVICIO DE M. NUCLEAR
La llegada al SMN de un paciente programado para un estudio PET-TAC de planificación será comunicado de inmediato a la enfermera responsable quien informará a su vez al técnico que realizará la exploración para la programación del estudio y al médico responsable.
Se verificarán los datos de cada paciente antes de proceder a cualquier intervención.
El facultativo o enfermera responsable de la exploración realizará un minicuestionario al paciente revisando específicamente medicación, ayuno, historial de alergias, contraindicación de relajante muscular o contraste IV.
El paciente permanecerá tumbado en la camilla, arropado con una manta, (durante unos 45-60 minutos) en penumbra, sin estímulos luminosos ni auditivos. No hablará ni masticará. Podrá levantarse a orinar.
En exploraciones centradas en área pélvica puede ser necesario sondar al paciente y realizar llenado vesical de 200-250 ml para garantizar un posicionado reproducible, de estructuras pélvicas adyacentes, con el que se va a realizar durante toda la planificación. La colocación de este sondaje se realizará antes del posicionado final del paciente previo a la adquisición de estudio PET-TC de planificación[47].
TÉCNICA DE ADMINISTRACIÓN
Intravenosa con el protector de jeringa. Se evitará la administración a través de catéteres y dispositivos permanentes.
Con el paciente sentado se canalizará una vía intravenosa con llave de 3 pasos. Se preparará una conexión a un suero fisiológico. Se verificará la permeabilidad de la vía con 5-10 ml de SF antes y después de la administración de la FDG, evitando en todo momento la extravasación.
Cualquier eventualidad durante la inyección debe ser comunicada al médico responsable de la misma así como anotada en la hoja de recogida de datos si se considerase relevante. En el caso de extravasación se reflejará en la hoja de recogida de datos del paciente y se seguirá todo el procedimiento habitual.
Se suministrará 500 cc de SF durante los 50 primeros minutos de la espera.
En el caso de lesión ganglionar o mamaria conocida se administrará el radiofármaco en la extremidad contralateral.
A los 45 minutos de la administración se quitará la vía al paciente y se le indicará que orine. En el caso de exploraciones con contraste IV solo se quitará la llave de 3 pasos[48].
En los estudios TC para la planificación de RT se ha empleado asiduamente medio de contraste oral para mejor identificar el tubo digestivo y medio de contraste i.v. para realzar el tumor e identificar estructuras vasculares. El medio de contraste puede generar artefactos en las imágenes PET si el TC para corregir la atenuación (CTAC) se realiza tras su administración[49]. El problema es relevante si la concentración del medio de contraste se traduce en niveles de radiodensidad mayores de 200HU. Sin embargo, aunque el aumento de SUV en las regiones con alta concentración de contraste es significativo cuando se utiliza el mismo en el CTAC, este aumento es clínicamente irrelevante. El medio de contraste oral neutro de baja densidad (sulfato de bario al 0,1%) ha sido evaluado con éxito, no produciendo errores clínicamente detectables en estudios PET corregidos por atenuación. Se ha utilizado contraste en los PET-TC de planificación de radioterapia en diversas localizaciones anatómicas sin aparente interferencia con los resultados clínicos[50].
Control Oral
Se empleará agua como contraste oral negativo en todos los casos.
Protocolo de administración:
Contraste IV
Debe prestarse atención especial a la permeabilidad de la vía iv que se utilizará para la infusión de contraste y al funcionamiento correcto de la bomba de infusión. Una extravasación o infusión inadecuada puede arruinar el procedimiento por comprometer la calidad de las imágenes TC o por ocasionar movimientos en el paciente por dolor en el lugar de la punción. Será conveniente administrar una embolada de prueba con suero salino. Los inyectores de contraste modernos permiten programar esta embolada de prueba.
Se administra contraste durante la adquisición de los datos de TC para CA.
El retardo en la adquisición será el determinado y específico de cada exploración. 20-30 seg para tumores de cabeza y cuello y 60 para el resto de casos aunque el protocolo puede variar dependiendo de las preferencias.
El intervalo entre la inyección de FDG y la adquisición de imágenes (período de incorporación) es quizás el parámetro más crítico.
Habitualmente se realiza un estudio de cuerpo completo a los 60 min. Se puede realizar una adquisición tardía selectiva de la localización a planificar a las 3 horas debido a su mayor sensibilidad de detección tumoral. No obstante, la concentración de radiofármaco en los procesos malignos aumenta durante al menos 90 minutos después de la inyección de FDG. Por lo tanto en estudios seriados es difícil comparar los datos de SUV que se miden en diferentes tiempos después de la inyección y se debe mantener el rango de las variaciones de la incorporación por debajo de 10 min[51].
En la práctica clínica esto requiere una planificación cuidadosa del tiempo entre la inyección de FDG y el comienzo de la exploración. Si se sigue un protocolo estricto para la adquisición de datos y el análisis, los datos de SUV representan un parámetro bastante estable que se puede medir con alta reproducibilidad[52].
Los pacientes deben vaciar la vejiga antes de la adquisición de las imágenes para limitar la radiación en el sistema urinario.
Se deben retirar los objetos metálicos, cuando sea posible.
Para la adquisición del campo de detección de la región anatómica a tratar con radioterapia, se utilizará la camilla plana, semejante a la camilla utilizada en la sala de tratamiento de radioterapia. Se colocará al paciente cuidadosamente en la misma posición que para la simulación y el tratamiento, guiándose con rayos láser de alineación y se guiará con las marcas en la piel que definen el área de tratamiento. Se inmovilizará al paciente con los mismos dispositivos empleados durante el tratamiento. Si se han hecho moldes de material termoplástico, se usarán para mantener al paciente en la posición adecuada[53]. (Figura 26)
Figura 26. Colocación del paciente
Para completar el estudio de extensión se recomienda completar la adquisición entre la base del cráneo y el tercio proximal del muslo. Para los tumores que tienen afinidad por el cuero cabelludo, calota o cerebro, se debe incluir la cabeza en el campo de exploración.
Para realizar el estudio de cabeza-cuello en condiciones óptimas, los brazos deben estar extendidos, junto al cuerpo.
Para realizar el estudio de tórax-abdomen-pelvis en condiciones óptimas, el paciente debe ser colocado con los brazos elevados encima de la cabeza, para evitar los artefactos de endurecimiento del haz, así como artefactos causados por el truncamiento del campo de visión en la imagen de TC.
El estudio de pelvis se adquiere en decúbito prono con vejiga llena en el caso de planificación de tumores rectales.
Generalmente se realiza la adquisición de las imágenes mediante movimiento de la camilla a través del campo de detección, hasta completar la región a examinar. Dependiendo de los modelos de tomógrafo, el campo de detección axial puede medir 15-25 cm y suelen ser necesarios 5-10 movimientos de la camilla para un cuerpo completo, con una duración para cada posición de camilla de 2-5 minutos.
La TC tiene varias funciones: corrección de atenuación, localización de las lesiones hipermetabólicas y delimitación de contornos en la planificación de la radioterapia. Además puede tener una finalidad diagnóstica.
Cuando la TC es sólo para corrección de atenuación, se realiza con un bajo miliamperaje (40-50 mAs) para reducir la dosis de radiación al paciente. Pero la adquisición TC de la región anatómica a tratar con radioterapia se realiza con mayor miliamperaje (>120 mAs), para obtener un estudio de buena calidad que permita la delimitación de contornos y sin medios de contraste.
Cuando la TC se efectúa con utilidad diagnóstica, se realizará una modulación de la corriente del tubo, con administración de contraste intravenoso. El uso de contraste intraluminal proporciona una adecuada visualización del tracto gastrointestinal. El agente puede ser un contraste positivo (como el bario diluido) o un contraste negativo (como el agua). La concentración de bario muy elevada produce un artefacto de atenuación con una sobrestimación significativa de la concentración de 18F-FDG, por ello es necesaria su dilución para garantizar la calidad de la imagen PET.
Una vez finalizado el estudio de TC, la camilla se desplaza para posicionar al paciente en el campo de visión del tomógrafo PET. El operador determina el momento del inicio de la exploración, así como la dirección de la camilla durante la exploración, que será caudo-craneal cuando se quiera disminuir el artefacto producido por la acumulación del radiofármaco en la vejiga. El estudio de emisión se realiza adquiriendo los sinogramas o proyecciones en las posiciones de la camilla que cubren el campo explorado por la TC. El tiempo de adquisición por posición de camilla y el intervalo explorado determinan el tiempo total de adquisición del estudio de emisión PET que, según los modelos de tomógrafo (posibilidad de 2D o 3D), puede oscilar entre 6 y 35 minutos. La realización de imágenes tardías de PET, entre 90 y 180 minutos post-inyección del radiofármaco, permite mejorar la relación lesión/fondo, con lo que puede facilitar la interpretación de los estudios.
Los criterios interpretativos de la Tomografía por Emisión de Positrones (PET) con 18F-Fluoro-Deoxiglucosa (FDG) para el diagnóstico de enfermedad tumoral han sido ampliamente reflejados en la literatura y recientemente recogidos en una revisión publicada en la Revista Española de Medicina Nuclear46.
Los valores de Sensibilidad y Especificidad de la PET para cada tumor y situación concreta influyen directamente en la planificación de Radioterapia. De modo general, si el objetivo es tratar toda la enfermedad tumoral, debemos adoptar criterios interpretativos con una alta sensibilidad (asumiendo una baja especificidad) y que probablemente se incluya en el campo de radioterapia tejido no tumoral. Este puede ser el caso de tratamientos con intención curativa y cualquier depósito ganglionar anómalo del trazador, regional o a distancia del tumor primario deberá considerarse como positivo e incluirse en el volumen de radiación. Al contrario, si el objetivo es evitar incluir tejido no tumoral, para disminuir por ejemplo la morbilidad, deberemos adoptar criterios interpretativos con mayor especificidad, asumiendo un incremento del riesgo de recaída. En esta disyuntiva es obligado agotar los procedimientos diagnósticos, incluido la biopsia para descartar o confirmar la positividad de la PET antes de iniciar el planteamiento terapéutico.
La sensibilidad y especificidad de la PET con 18FDG es ligeramente superior que las exploraciones morfológicas convencionales para la estadificación ganglionar en tumores de cabeza y cuello, aunque los valores diagnósticos no muestran significación estadística. Sin embargo, esto no invalida la exploración como técnica complementaria con un potencial papel en la planificación de radioterapia. Las ventajas potenciales de la incorporación de la PET con 18FDG son: reducción de la variabilidad interobservador en la delimitación del GTV y reducción del tamaño del GTV, identificación de enfermedad activa que fuera obviada por técnicas complementarias (TC y/o RMN) y la posibilidad de identificar partes del GTV que podrían requerir dosis de radioterapia adicional23. Concretamente puede tener especial interés en la delimitación del GTV mediante el uso de métodos de segmentación automática y definir la distribución de isodosis en el tumor primario. Existen datos preliminares que pueden atribuirle un papel prometedor en los tratamientos adaptativos y el seguimiento de pacientes.
La PET es ampliamente usada para el diagnóstico estadificación, valoración precoz de respuesta terapéutica, reestadificación y diagnóstico de recidiva de una amplia diversidad de tumores gastrointestinales. Muestra una baja sensibilidad para detectar enfermedad ganglionar en el cáncer de esófago. Por tanto, no se puede omitir los campos de radiación de estas regiones si la exploración es negativa. La especificidad para descartar enfermedad es mayor[54], por lo que cualquier depósito ganglionar supraclavicular o del tronco celiaco puede considerarse positivo e incluirse en el GTV.
En conclusión, la interpretación de la PET para la selección de volúmenes y campos de radioterapia está en función de los valores diagnósticos intrínsecos para cada situación y el planteamiento de la intención terapéutica.
Interpretación
En primer lugar, se realizará una valoración visual. Se estimarán la distribución fisiológica de la FDG y las variantes de la normalidad[55]. Se considerará como lesión todo aumento de la captación de FDG en relación con el tejido circundante y/o región homóloga y que no se corresponda con captación fisiológica.
Opcionalmente se realizará estudio semicuantitativo mediante determinación de los índices SUV de cada lesión observada, considerando el SUV como la captación del radiofármaco (FDG) en la región de interés (ROI), expresado en MBq/ml en relación con la dosis inyectada y el peso corporal del paciente en gramos. Para la mayoría de los tumores, se ha descrito como umbral entre benignidad y malignidad un SUV de 2,5-3. Estos datos se refieren al estudio PET en que se realiza el mapeo de atenuación con fuentes isotópicas (68Ge o 137Cs); sin embargo, se ha observado que las imágenes con corrección de TC presentan una captación significativamente mayor que las obtenidas con fuente isotópica y, por lo tanto, debe tenerse en cuenta este hecho en la interpretación del SUV para el diagnóstico de malignidad.
El valor del índice SUV está influenciado primariamente por factores biológicos y la histología del tumor. Por otro lado, en la valoración del SUV se deben considerar una serie de factores que afectan a su interpretación28. Estos factores son: el momento en el que se obtiene el SUV, los niveles de glucosa endógenos, el efecto parcial de volumen, el tamaño y la ubicación de la región de interés (ROI) sobre el foco en la imagen.
La distribución de la FDG a lo largo del organismo no es homogénea, encontrándose una mayor captación en tejido muscular que en tejido graso. Debido a ello se han realizado modificaciones para el cálculo del SUV que tengan en cuenta estas variaciones y la constitución del paciente, corrigiendo los valores por la superficie corporal o la masa muscular.
Todos estos factores tienen menos influencia cuando se utiliza el SUV para la monitorización de la respuesta terapéutica, al asumirse su valor relativo y su valoración evolutiva. No obstante, la determinación del SUV debe ser estandarizada, idealmente realizar los estudios evolutivos con el mismo tomógrafo, similar dosis del radiofármaco inyectado, etc. Esta estandarización ha sido recientemente recogida en varios documentos de consenso.
La captación fisiológica de 18F-FDG se observa en tejidos viables, incluidos cerebro, miocardio, mama, hígado, bazo, estómago, intestino, riñones y vejiga, músculo, tejido linfoide, médula ósea, glándulas salivales, timo, útero, ovarios, testículos y grasa parda. Para estudios de cuerpo completo, la 18F-FDG es poco sensible en la detección de las metástasis cerebrales, debido a la elevada captación fisiológica en la sustancia gris.
La elevada captación de 18F-FDG se observa en los procesos neoplásicos, pero también en el tejido de granulación (heridas), las infecciones y otros procesos inflamatorios, que deben conocerse y ser tenidos en cuenta para la correcta interpretación del estudio[56].
En la diferenciación entre lesiones benignas o malignas, los patrones de captación de 18F-FDG y los hallazgos específicos de la TC son útiles valorados con la correlación de la historia clínica, el examen físico y otras técnicas de imagen.
En la evaluación de la terapia es especialmente necesario realizar una estimación semicuantitativa (SUV).
Hay un amplio espectro para la cuantificación de la concentración de FDG en un paciente oncológico: Desde el cualitativo en el que sólo se necesita una buena calidad de imagen, hasta la descripción cuantitativa espacio-temporal, que requiere de métodos cinéticos, estudios dinámicos y un análisis de datos complejo. A medio camino está la determinación de SUV.
El SUV es el acrónimo de Standardized Uptake Value (valor estándar de captación), es una medida de la concentración de actividad (Bq/ml) de una determinada región. La expresión para calcularla es:
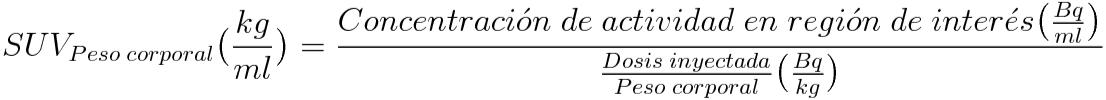
La intención de esta definición es que se pudieran tener valores de una magnitud que sirvieran como referencia, haciéndolos independientes del estudio y paciente, de manera que una determinada captación se considera patológica si supera un determinado valor. Sin embargo hay muchos otros factores que modifican el valor de la captación y que hacen del SUV un valor difícilmente controlable[57].
Por tanto el valor del SUV no es una magnitud física real sino que depende de factores como el tamaño del voxel, el movimiento del paciente, las características del PET, la técnica de reconstrucción de imagen, y el número de iteraciones en la reconstrucción.
5.6 ASPECTOS FÍSICOS Y DE RADIOPROTECCIÓN
La incorporación de la imagen funcional en el proceso radioterápico, supone que en los datos de entrada, además de la información anatómica (suministrada por la tomografía computerizada y la resonancia magnética nuclear, fundamentalmente), se incluye información biológica que proporciona datos sobre la heterogeneidad funcional y molecular de los tejidos que constituirán el blanco de radiación y eventualmente, los tejidos sanos.
La inclusión de la imagen multimodalidad en general y la imagen funcional en particular supone modificar el proceso radioterápico, de manera que hay que realizar dos pasos previos antes proceder a realizar la prescripción del tratamiento, diseño de volúmenes, posterior planificación y verificación del tratamiento hasta finalmente impartir las de las dosis de radiación. Estos pasos previos son:
Estos dos pasos previos permitirán efectuar la prescripción, contorneo de volúmenes, elaboración y verificación del plan de tratamiento, etc., continuando con el proceso radioterápico.
El objetivo del control de calidad del sistema PET-TC es verificar la integridad operacional de los detectores y la electrónica de adquisición con objeto de mantener una alta calidad de imagen y que sea consistente con el fin perseguido, minimizando la aparición de artefactos.
Este objetivo, cuando se incorpora la imagen PET-TC en radioterapia, implica satisfacer los requerimientos en cuanto a la precisión en la cuantificación y el registro.
Esto supone realizar las pruebas comunes a los equipos TC usados en radioterapia, como son las que nombramos a continuación[58].
Además hay que añadir aquellos aspectos nuevos relativos a las capacidades y características de la imagen funcional PET; Hay que considerar la coincidencia entre los estudios de TC y PET, nuevas funcionalidades relacionadas con el registro, fusión y segmentación, e influencia de la calibración del activímetro.
Radioprotección del paciente y de los trabajadores.
Dentro del apartado de protección radiológica hay que establecer los niveles de radiación dentro de la sala y la dosis recibida por los Técnicos Especialistas de Medicina Nuclear, Técnicos Especialistas en Radioterapia y los pacientes. (Figura 27)
Figura 27. Protección radiológica en Medicina Nuclear
Criterio ALARA. El técnico de radioterapia debe conocer que está manejando un paciente con un radionúclido inyectado: el paciente es una fuente de radiación externa y de contaminación. Es obligatorio actuar con destreza y con la preparación previa necesaria para reducir el tiempo de exposición junto al paciente. El uso de calzas, guantes, y delantales desechables reducirán la posible contaminación por contacto con el paciente. (Figura 28)
Figura 28. Medidas de Protección Radiológica
En virtud del criterio ALARA, los inmovilizadores, cunas de vacío, máscaras, etc. se deben preparar previamente sin el paciente inyectado, y ser reposicionado después en la unidad PET-TC para la adquisición de imagen. En el caso de la localización de los tatuajes, puede ser preferible el tatuaje del paciente no en el momento de la preparación del inmovilizador sino cuando el paciente esté colocado en la mesa de exploración. La explicación está en que el tiempo que se tarda en recolocar a un paciente previamente tatuado, una vez que está inyectado, respecto a los láseres de la sala del PET-TC es superior al tiempo que se tarda en colocar las marcas radio-opacas y dejar señalado la posición de las mismas. El tatuaje definitivo puede ser realizado al finalizar el estudio, cuando la actividad es menor que al inicio del mismo.
El técnico de medicina nuclear debe conocer que el paciente recibirá un tratamiento radioterápico que se sustenta en la geometría y el origen de coordenadas que se fijen durante la adquisición de las imágenes, por lo que deberá estar familiarizado con el lenguaje y las técnicas empleadas.
No es despreciable la probabilidad de contaminación debido a alguna incidencia durante el transcurso del estudio, como vómitos o pérdidas de orina. Se deberá entrenar a todo el personal para saber proceder ante tal evento y no dispersar más la contaminación ya creada. Se deberá contar con material apropiado para descontaminación y detectores de contaminación. En caso de contaminar la propia máquina PET-TC puede que se haga necesaria una descontaminación de la misma antes de continuar con más estudios.
El uso de ropa protectora no es efectivo para la energía de los fotones de aniquilación (511 keV), ya que el 90% de los fotones atraviesan los espesores de Pb típicos empleados.
El uso de listas de chequeo antes y durante el estudio, para protocolizar todos los posibles aspectos de la simulación del paciente, pueden conseguir la disminución del tiempo de exposición y la probabilidad de error en el estudio. Así se minimizará la probabilidad de repetición del estudio al paciente. También hay que establecer líneas claras de comunicación entre el Servicio de Oncología Radioterápica y el Servicio de Medicina Nuclear para que no haya errores de transmisión de información que puedan provocar errores de administración del radiofármaco.
Se deberá prestar especial atención a embarazo y lactancia, infancia y dosis a trabajadores, siguiendo las medidas del Consejo de Seguridad Nuclear.
[1] NIH: Instituto Nacional del Cáncer. [actualizado 14/03/2016; citado 5/03/2017]. Disponible en: https://www.cancer.gov/espanol/cancer/naturaleza/estadisticas
[2] GBD 2015 Risk Factors Collaborators. Global, regional, and national comparative risk assessment of 79 behavioural, environmental and occupational, and metabolic risks or clusters of risks, 1990-2015: a systematic analysis for the Global Burden of Disease Study 2015. Lancet. 2016 Oct; 388 (10053):1659-1724.
[3] Plummer M, de Martel C, Vignat J, Ferlay J, Bray F, Franceschi S. Global burden of cancers attributable to infections in 2012: a synthetic analysis. Lancet Glob Health. 2016 Sep;4(9):e609-16. doi: 10.1016/S2214-109X(16)30143-7.
[4] Stewart BW, Wild CP, editors. World cancer report 2014. Lyon: International Agency for Research on Cancer; 2014.
[5] Noncommunicable diseases and mental health. WHO. Publication date:2013
ISBN:978 92 4 150623 6
[6] Menu Y. Evaluation of tumour response to treatment with targeted therapies: standard or targeted criteria?. Bull Cancer. 2007; 94(7 Suppl):F231-9.
[7] Ze Jin, Hidetaka Arimura, Yoshiyuki Shioyama, Katsumasa Nakamura, Jumpei Kuwazuru, Taiki Magome, et all. Computer-assisted delineation of lung tumor regions in treatment planning CT images withPET/CT image sets based on an optimum contour selection method. J Radiat Res.2014 Nov;55(6): 1153–1162
[8] Carlson RW, Jonasch E. J Natl Compr Canc Netw NCCNEvidence Blocks. . 2016 May;14 (5 Suppl):616-9.
[9] Rizzoli R, Body JJ, Brandi ML, Cannata-Andia J, Chappard D, El Maghraoui A, Glüer CC, Kendler D, Napoli N, Papaioannou A, Pierroz DD, et all. Cancer-associated bone disease.; International Osteoporosis Foundation Committee of Scientific Advisors Working Group on Cancer-Induced Bone Disease. Osteoporos Int. 2013 Dec; 24(12):2929-53.
[10] Dauer LT, Hricak H. Addressing the challenge of managingradiationuse in medical imaging: paradigm shifts and strategic priorities. Oncology (Williston Park). 2014 Mar;28(3):243-4, 246.
[11] Panicek DM,HricakH. How Sure Are You, Doctor? A Standardized Lexicon to Describe theRadiologist´s Level of Certainty. AJR Am J Roentgenol. 2016 Jul;207(1):2-3.
[12] Brand C, Longo VA, Groaning M, Weber WA, Reiner T. Development of a New Folate-Derived Ga-68-Based PET Imaging Agent. Mol Imaging Biol. 2017 Feb 13
[13] JM Martí-Climent, I Peñuelas, R Calvo, M Giménez. Utilización de un ciclotrón para la producción de radioneucleidos emisores de positrones. Vol 18. Num 4. Julio 2009
[14] Patricio González E. Oncología: evaluación con tomografía computarizada con emisión de positrones. Medwave jun 2010; 10
[15] Salama JK, Haddad RI, Kies MS, et al. American Society for Therapeutic Radiology and Oncology (ASTRO) and American College of Radiology (ACR) practique guidelines for intensity-modulated radiation therepy (IMRT). Int J Radiat Oncol boil Phys 2009; 73 (1): 9-14
[16] Prawie , Oosting S, Chen T et al. Systemic therapies for recurrent/metastatic nasopharyngeal carcinoma (RM NCP). J Clin Oncol 2016; 34 (Suppl): Abstract 6031.
[17] Bayrak S, Kinaci E, Ozakay A, Bektas CT, Yardimci AH, et al. Preoperative localization of distal colorectal tumours. Ann Ital Chir. 2016;87:595-600.
[18] Dimitrova EG, Chaushev BG, Conev NV, Kashlov JK, Zlatarov AK, et al. Role of the pretreatment 18F-fluorodeoxyglucose positron emission tomography maximal standardized uptake value in predicting outcomes of colon liver metastases and that value´s association with Beclin-1 expression. Biosci Trends. 2017 Feb 28.
[19] Wagner F, Hakami YA, Warnock G, Fischer G, Huellner MW, Veit-Haibach P. Comparison of Contrast-Enhanced CT and [18F]FDG PET/CT Analysis Using Kurtosis and Skewness in Patients with Primary Colorectal Cancer. Mol Imaging Biol. 2017 Feb 21.
[20] Langhans L, Tvedskov TF, Klausen TL, Jensen MB, Talman ML, Vejborg I. Radioactive Seed Localization or Wire-guided Localization of Nonpalpable Invasive and In Situ Breast Cancer: A Randomized, Multicenter, Open-label Trial. Ann Surg. 2017 Mar 2.
[21] Ha JY, Jeon KN, Bae K, Choi BH. Effect of Bone Reading CT software on Radiologist Performance in Detecting Bone Metastases from Breast Cancer. Br J Radiol. 2017 Mar 3
[22] Shen G, Lan Y, Zhang K, Ren P, Jia Z. Comparison of 18F-FDG PET/CT and DWI for detection of mediastinal nodal metastasis in non-small cell lung cancer: A meta-analysis. PLoS One. 2017 Mar 2;12(3).
[23] García de Castro AB, Domínguez JF, Bolton RD, Pérez CF. PET-CT in presurgical lymph node staging in non-small cell lung cancer: the importance of false-negative and false-positive findings. Radiologia. 2017 Feb 23
[24] M.K. Gould,J. Donington,W.R. Lynch,P.J. Mazzone,D.E. Midthun,D.P. Naidich
Evaluation of individuals with pulmonary nodules: When is it lung cancer? Diagnosis and management of lung cancer, 3rd ed: American College of Chest Physicians evidence-based clinical practice guidelines
Chest, 143 (2013), pp. 93-120
[25] R.S. Wiener,L.M. Schwartz,S. Woloshin,H.G. Welch. Population-based risk for complications after transthoracic needle lung biopsy of a pulmonary nodule: An analysis of discharge records Ann Intern Med, 155 (2011), pp. 137-144
[26] Dimitrova EG, Chaushev BG, Conev NV. Role of the pretreatment 18F-fluorodeoxyglucose positron emission tomography maximal standardized uptake value in predicting outcomes of colon liver metastases and that value´s association with Beclin-1 expression. Biosci Trends. 2017 Feb 28
[27] Hennessy G, Vamadevan S, Loh H. Pancreatic Cancer Complicated by Pancreatitis Demonstrated on FDG PET/CT. Clin Nucl Med. 2017 Mar;42(3):239-240.
[28] Bärwolf R, Zirnsak M, Freesmeyer M. Breath-hold and free-breathing F-18-FDG-PET/CT in malignant melanoma-detection of additional tumoral foci and effects on quantitative parameters. J Korean Neurosurg Soc. 2017 Jan 1;60(1):98-101.
[29] Rubini G, Altini C, Notaristefano A, Merenda N. Role of 18F-FDG PET/CT in diagnosing peritoneal carcinomatosis in the restaging of patient with ovarian cancer as compared to contrast enhanced CT and tumor marker Ca-125. Rev Esp Med Nucl Imagen Mol. 2014 Jan-Feb;33(1):22-7.
[30] Garcia JR, Romera N, Cozar M, Soler M. (11)C-choline PET/CT and multiparametric MRI in patients with biochemical relapse of prostate cancer. Actas Urol Esp. 2015 May;39(4):259-63.
[31] Sasikumar A. Specificity of 68Ga-PSMA PET/CT for Prostate Cancer - Myths and Reality. Indian J Nucl Med. 2017 Jan-Mar;32(1):11-12.
[32] Garcia JR, Moreno C, Valls E, Cozar P. Diagnostic performance of bone scintigraphy and (11)C-Choline PET/CT in the detection of bone metastases in patients with biochemical recurrence of prostate cancer. Rev Esp Med Nucl Imagen Mol. 2015 May-Jun;34(3):155-61.
[33] Schmuck S, Mamach M, Wilke F, von Klot CA. Multiple Time-Point 68 Ga-PSMA I&T PET/CT for Characterization of Primary Prostate Cancer: Value of Early Dynamic and Delayed Imaging. Clin Nucl Med. 2017 Feb 17.
[34] Pelegrí Martínez L, Kohan AA, Vercher Conejero JL. Optimization of the protocols for the use of contrast agents in PET/CT studies. Radiologia. 2017 Jan - Feb; 59(1):64-74.
[35] Bar-Shalom R, Yefremov N, Guralnik L. Clinical performance of PET/CT in evaluation of cancer: additional value for diagnostic imaging and patient management. J Nucl Med. 2003 Aug;44(8):1200-9.
[36] Azad GK, Cook GJ. Multi-technique imaging of bone metastases: spotlight on PET-CT.
Clin Radiol. 2016 Jul;71(7):620-31
[37] Lodge MA. Repeatability of Standardized Uptake Value in Oncologic 18F-FDG PET. J Nucl Med. 2017 Feb 23.
[38] Guerreiro F, Burgos N, Dunlop A, Wong K, Petkar I. Evaluation of a multi-atlas CT synthesis approach for MRI-only radiotherapy treatment planning. Phys Med. 2017 Feb 24. pii: S1120-1797(17)30045-5.
[39] Lin C, Huang T, Lin C, Nien H, Tu P, Lui L, Wu C. SU-F-T-389: Validation in 4D Dosimetry Using Dynamic Phantom. Med Phys. 2016 Jun;43(6):3552-3553.
[40] Facey K, Bradbury I, Laking G, Payne E. Overview of the clinical effectiveness of positron emission tomography imaging in selected cancers. Health Technol Assess. 2007 Oct;11(44).
[41] MUFACE. Guía PET-TC. Protocolo de Prescripción. Mutualidad General de Funcionarios Civiles del Estado. Madrid, 2011.www.muface.es.
[42] PET in radiotherapy planning. Radiother Oncol. 2010 Sep; 96(3):275-356.
[43] Utilidad de la PET-TAC en Oncología. Arán ediciones. 2010 Madrid. ISBN:978-84-92977-14-7.
[44] Nestle U, Kremp S, Grosu AL. Practical integration of [18F]-FDG-PET and PET-CT in the planning of radiotherapy for non-small cell lung cancer (NSCLC): the technical basis, ICRU-target volumes, problems, perspectives. Radiother Oncol. 2006 ; 81:209-2.
[45] M. E. Castellanos; T. Lacornerie; B. Prevost; X. Mirabel; E. Lartigau. Sistemas de contención de órganos en movimiento: Radioterapia Adaptada a la Respiración (RAR). Centro Regional de Lucha contra el Cáncer. Centro Oscar Lambret. Lille (Francia)
[46] García Garzón JR, Rodríguez A, Cabrera A. Tomografía por emisión de positrones de cuerpo completo (PET/TAC) con 18F-fluorodesoxiglucosa. Rev Esp Med Nucl 2009; 28:85-9
[47] Jalilian AR, Beiki D, Hassanzadeh-Rad A, Eftekhari A, Geramifar P, Eftekhari M. Production and Clinical Applications of Radiopharmaceuticals and Medical Radioisotopes in Iran. Semin Nucl Med. 2016 Jul;46(4):340-58.
[48] Counting Rate Characteristics and Image Distortion in Preclinical PET Imaging During Radiopharmaceutical Therapy.Mellhammar E, Dahlbom M, Axelsson J, Strand SE. J Nucl Med. 2016 Dec;57(12):1964-1970
[49] Otero HJ, Yap JT, Patak MA, Erturk SM, Israel DA, Johnston CJ, Sakelis C, Rybicki FJ, Van den Abbeele AD, Ros PR. Evaluation of low-density neutral oral contrast material in PET/CT for tumor imaging: Results of a randomized clinical trial. AJR Am J Roentgenol 2009; 193:326-32.
[50] Bannas P, Weber C, Adam G, et al. Contrast-Enhanced [(18)F]fluorodeoxyglucose-Positron Emission Tomography/Computed Tomography for staging and radiotherapy planning in patients with anal cancer. Int J Radiat Oncol Biol Phys 2010
[51] Ronald Boellaard, Mike J. O’Doherty, Wolfgang A. Weber, Felix M. Mottaghy, Markus N.
Lonsdale, Sigrid G. Stroobants, Wim J. G. Oyen, Joerg Kotzerke, Otto S. Hoekstra and Jan Pruim, et al. FDG PET and PET/CT: EANM procedure guidelines for tumour PET imaging: version 1.0 European Journal of Nuclear Medicine and Molecular Imaging, 2010; 37: 181-200.
[52] Debelke D, Coleman E, Guiberteau M, et al. Procedure Guideline for tumor Imaging with F-FDG PET/CT 1.0. http://interactive.snm.org/docs/jnm30551_ [citado 5/03/2017]online.pdf
[53] Coffey M, Vaandering A. Patient setup for PET/CT acquisition in radiotherapy planning. Radiother Oncol. 2010;96:298-301.
[54] Shimizu S, Hosokawa M, Itoh K, Fujita M, Takahashi H, Shirato H. Can hybrid FDG-PET/CT detect subclinical lymph node metastasis of esophageal cancer appropriately and contribute to radiation treatment planning? A comparison of image-based an pathological findings. Int J Clin Oncol 2009;14:421–5.
55 Cook GJ, Fogelman I, Maisey MN. Normal physiological and benign pathological variants of 18-fluoro-2-deoxyglucose positron-emission tomography scanning: potential for error in interpretation. Semin Nucl Med 1996; 26: 308-14
[56] Weber WA. Quantitative analysis of PET studies. Radiother Oncol. 2010 Sep; 96(3):308-10.
[57]Shankar et al: Consensus Recommendations for the Use of 18F-FDG PET as an indicator od Therapeutic Response in NCI Trials. Journal of Nuclear Medicine Vol. 47 No. 6 1059-1066.
[58] Quality assurance for computed-tomography simulators and the computed tomography-simulation process: Report of the AAPM Radiation Therapy Committee Task Group No. 66